 您的购物车当前为空
您的购物车当前为空
2025盘点:FDA批准的46款新药

截至 2025 年 12 月 31 日,美国食品药品监督管理局(FDA)药物评估与研究中心(CDER)于2025年度批准了 46 款新治疗药物。此文将总结 2025 年 FDA 批准的创新疗法。
文末附有 46 款新药信息归纳表,记得点击保存噢~
CDER:批准了46款新药
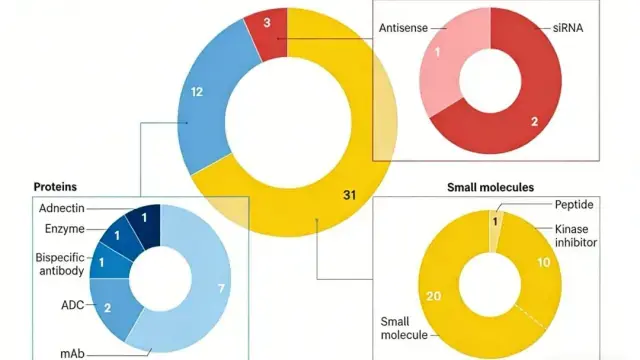
结合 1994 年到 2025 年的数据分析来看,2025 年 FDA 旗下 CDER 批准了 46 款新药,虽较去年有所下降,但仍高于历史平均水平且"first-in-class"药物占比过半,彰显了审批对创新质量的聚焦。同时,FDA 生物制品评估与研究中心(CBER)也批准了 8 款重要新产品,包括首款来自非营利组织的基因疗法。
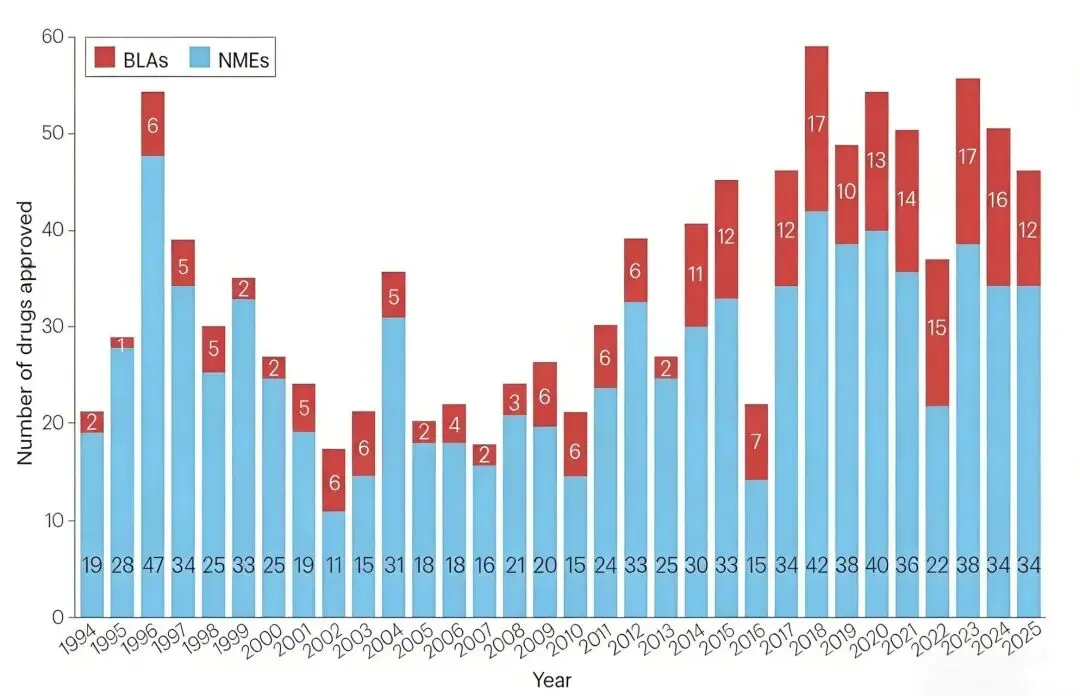
1994—2025年,FDA每年批准的新分子实体(NMEs)和生物制品许可申请(BLAs)数量
在治疗领域的分布上,肿瘤学仍是核心赛道,共有16款新药获批,占比35%,高于近五年29%的滚动平均值;心脏病学(5款,占11%)、过敏与炎症性疾病(4款,占9%)紧随其后,构成了非肿瘤领域的核心创新阵地。
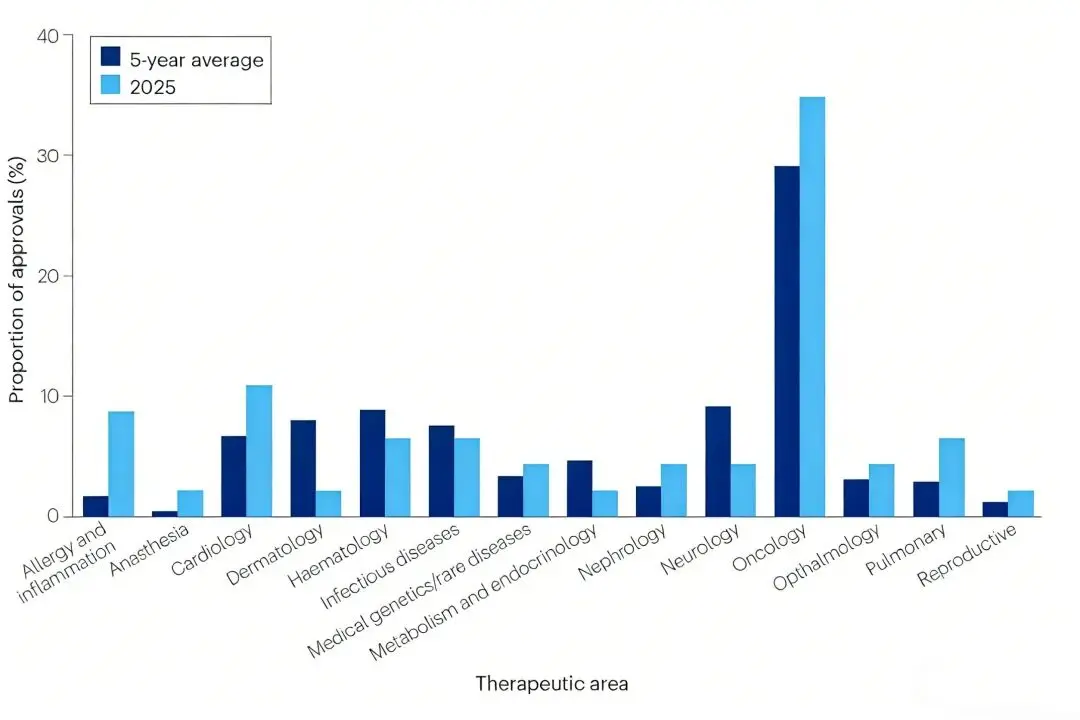
按治疗领域划分的CDER批准情况
在治疗模式上,小分子药物依然占据主导地位,占比达66%,其中激酶抑制剂、蛋白酶体抑制剂等靶向小分子药物占比超80%,精准治疗的发展趋势愈发明确;与此同时,生物制剂占比提升至34%,较2024年增长3%,单克隆抗体、抗体药物偶联物(ADC)等产品的技术成熟度持续提升,成为推动新药创新的重要力量。
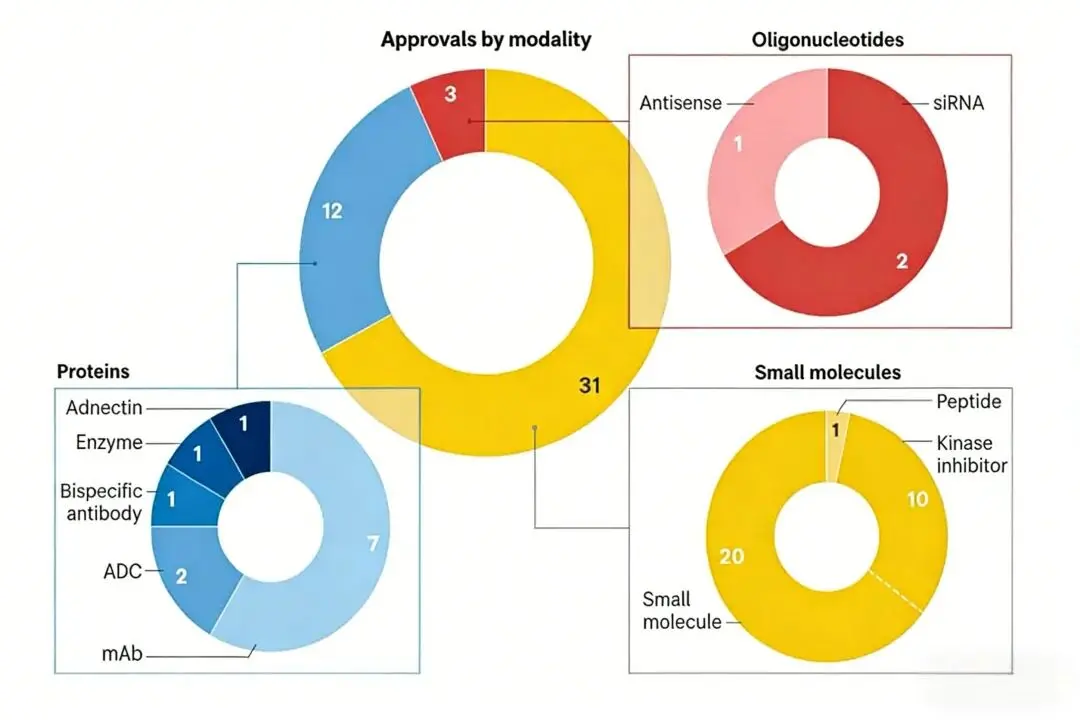
按给药方式划分的CDER批准情况
三种癌症创新治疗法
抗体偶联药物(ADC)新成员
第一三共的TROP2 靶向ADC 药物Datopotamab deruxtecan-dlnk 获批用于激素受体阳性、HER2 阴性乳腺癌;
艾伯维的 c-Met 靶向 ADC 药物Telisotuzumab vedotin 则针对高 c-Met 蛋白过表达的非鳞状非小细胞肺癌。
PD-1 抑制剂家族扩容
康方生物的 PD-1 单抗派安普利单抗 获批用于鼻咽癌治疗,使全球可用的 PD-1/PD-L1 抗体增至 12 款;
默克的 Pembrolizumab 皮下注射剂型获批,结合透明质酸酶提高药物渗透吸收,预计峰值销售额可达 93 亿美元。
创新组合疗法
Verastem 公司的 avutometinib 联合 defactinib 获批,成为首个 MEK 抑制剂与 FAK 抑制剂组合,用于 KRAS 突变的复发性低级别浆液性卵巢癌。
三大非癌症领域新药
非阿片类止痛药
Vertex 公司的 Nav1.8 钠通道抑制剂 Suzetrigine 获批用于急性疼痛,为临床提供了急需的非成瘾性止痛选择,预计峰值销售额 37 亿美元。
肺部疾病新药
Insmed 的首款 DPP1 抑制剂 Brensocatib 获批用于非囊性纤维化支气管扩张症,通过抑制中性粒细胞丝氨酸蛋白酶缓解炎症,预计峰值销售额 63 亿美元;
勃林格殷格翰的 Nerandomilast 成为首款用于特发性肺纤维化的 PDE4 抑制剂,填补了该领域十年无新药的空白。
抗生素新选择
葛兰素史克的 Gepotidacin 和 Innoviva 的 Zoliflodacin 均为新型细菌 II 型拓扑异构酶抑制剂,获批用于治疗淋病等感染,为应对抗生素耐药提供了新工具。
技术革新
新模态
2025 年获批新药涵盖多种创新技术模态,包括首款基于 adnectin 的生物疗法 ——LIB Therapeutics 的 PCSK9 抑制剂 Lerodalcibep ,其结构比传统单抗更小、更稳定,且每月仅需皮下注射一次。
基因疗法
非营利组织 Fondazione Telethon 研发的 Etuvetidigene autotemcel 获批用于治疗威斯科特 - 奥尔德里奇综合征,成为首款由非营利组织开发并获批的基因疗法。
Abeona 公司的 Prademagene zamikeracel 是首款基于细胞片的基因疗法,用于治疗隐性营养不良性大疱性表皮松解症,通过移植含胶原蛋白基因的皮肤细胞片修复伤口。
Moderna 的新一代 mRNA 新冠疫苗获批,每剂 mRNA 用量仅为初代产品的五分之一,预计销售额超 32 亿美元。
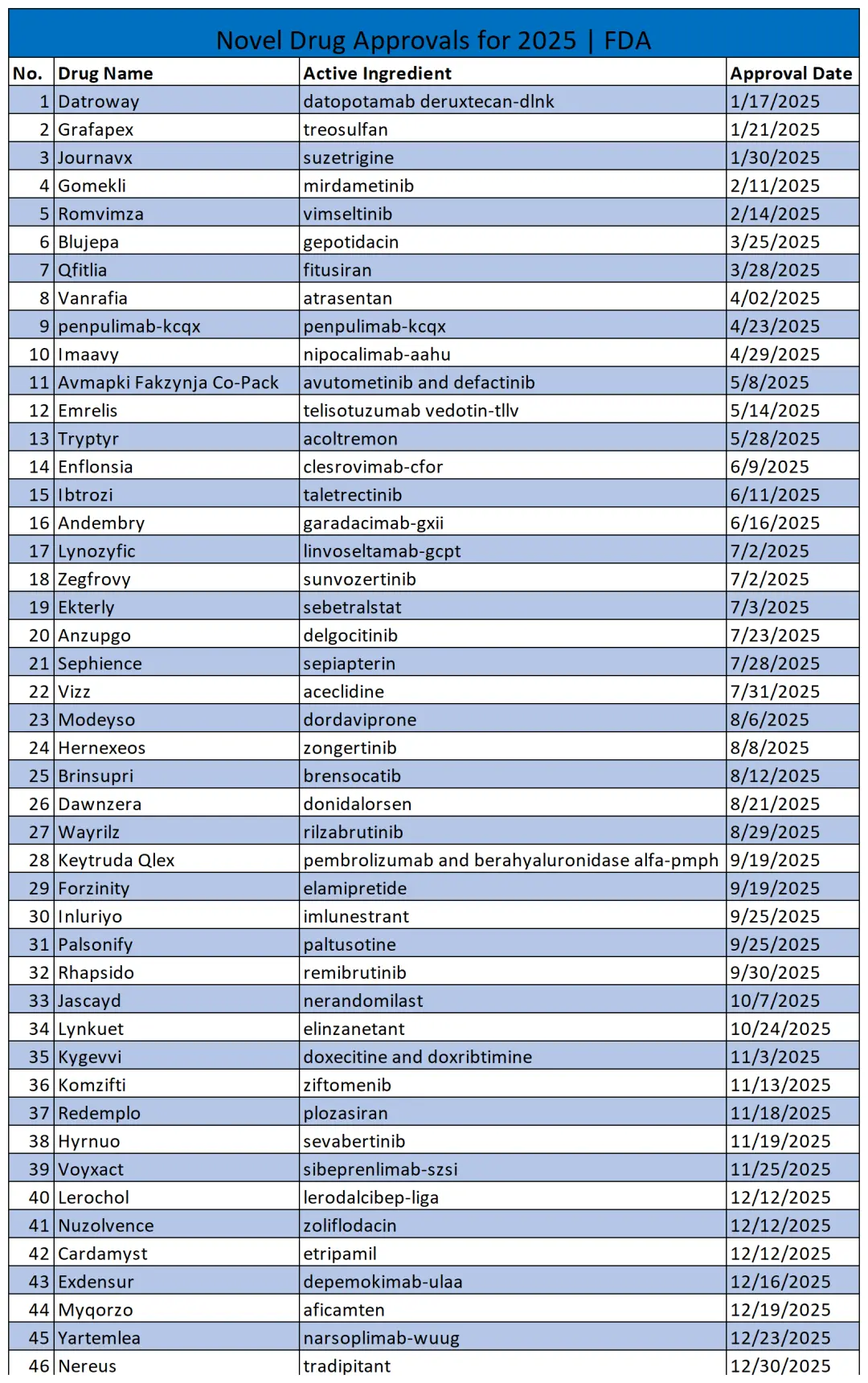
附:2025 FDA批准的46款新药
(需要详细表格的可添加客服微信topscience01)
其他文章

订阅TargetMol新闻
科学新闻、观点和分析的重要汇总,每个工作日都会发送到您的收件箱.




 |
|