 您的购物车当前为空
您的购物车当前为空
体内应用的邻近标记技术 | 增强抗原诱导的T细胞反应

肿瘤相关抗原密度不足,一直是现有免疫疗法面临的难题。传统解决策略,如优化 CAR/TCR 或抗体设计、增加细胞表面抗原表达、利用溶瘤病毒诱导抗原呈现等,往往存在提升幅度有限、特异性不足或潜在毒性风险等问题。
2025 年 9 月 10 日,中国科学院分子细胞卓越创新中心韩硕团队联合复旦大学附属中山医院高强团队,在 Nature 发表了题为 Amplifying antigen-induced cellular responses with proximity labelling 的研究论文。
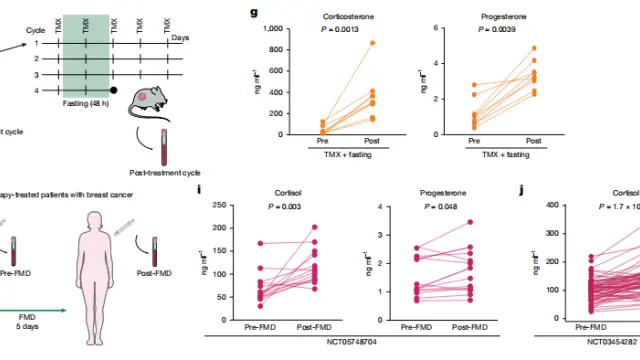
该研究提出了一种基于邻近标记(proximity labelling)的新策略,通过高效放大抗原信号,成功克服了低密度肿瘤抗原导致的受体聚集受限与免疫激活不足问题。值得一提的是在研究过程中,团队使用了 TargetMol 的产品噢,大佬的选择,值得信赖!

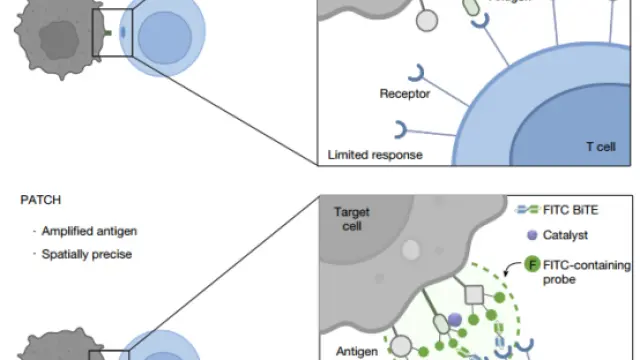
PATCH技术
邻近标记(proximity labeling)是一项新兴技术,其核心原理是利用特定的酶将标记物(如生物素)共价连接到目标蛋白附近的蛋白质上,从而实现对邻近蛋白质的标记和分析。
在最新研究中,研究团队开发了可在体内应用的邻近标记技术——Proximity Amplification and Tagging of Cytotoxic Haptens(PATCH),可在红光(>680nm)或超声控制下,在肿瘤细胞表面实现高密度的荧光素(FITC)共价标记,从而放大抗原信号并促进T细胞受体(TCR)的聚集,形成高密度合成抗原簇。
这种抗原簇(PATCH)显著增强了T细胞活化与细胞毒性,可诱导肿瘤快速清除并产生持久免疫记忆。
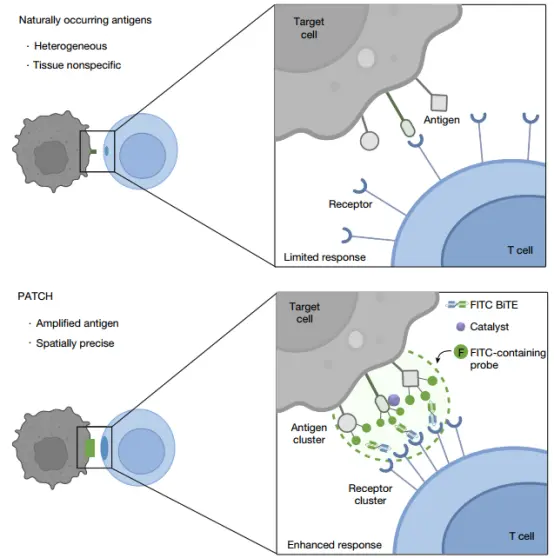
该技术的关键在于 PCN 纳米酶。PCN 纳米酶具有良好的生物相容性和化学稳定性,可被 红光或超声 激活,具备体内应用和成像潜力。
红光激活下,PCN 纳米酶可通过苯氧自由基机制实现蛋白(如 BSA)上酪氨酸残基的高效生物素化;
超声激活下,PCN 纳米酶可通过单线态氧机制标记组氨酸残基,并能在短时间(5 分钟)内完成高效标记。
PCN 纳米酶首先会被靶向递送至肿瘤细胞表面,随后通过外部的红光或超声进行精准、无创的激活。被激活的纳米酶会催化含有人工抗原(FITC)的探针分子,使其与纳米酶周围(纳米级别内)的细胞表面蛋白发生快速、大量的共价连接,在靶细胞表面构建高密度抗原簇,并结合 FITC 结合双特异性T细胞衔接器(BiTE),诱导 T 细胞受体聚集和活化,增强其对肿瘤细胞的识别和杀伤。
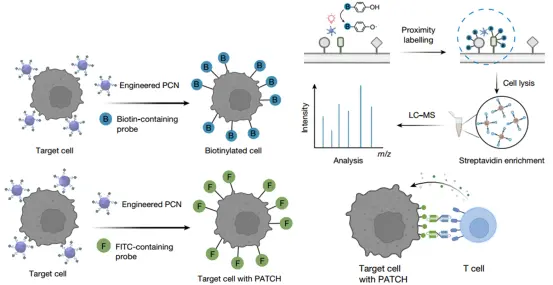
PATCH 在靶细胞表面触发 TCR 激活与 T 细胞杀伤作用
实验显示,PATCH 显著提升了 T 细胞对肿瘤细胞的杀伤能力和细胞因子分泌(TNF、IFNγ),使T细胞的抗原检测灵敏度比传统抗体方法高出 250 倍以上。
抗肿瘤效果
• 研究人员在多种免疫健全小鼠实体瘤模型中验证了红光或者超声激活的 PATCH 在体内的抗肿瘤效果。
• 在乳腺癌 4T1 模型中经两次 PATCH 处理和 BiTE 注射后,即可实现实现 完全肿瘤清除,而对照处理则无法阻止肿瘤进展;
• M109 肺癌模型中,单次PATCH处理后10天,肿瘤缩小至检测不到水平;
• CT26-HER2 结直肠癌模型中,红光或超声激活的PATCH 均使 肿瘤快速消退,显著延长小鼠生存期;
• 在人源化小鼠模型中,移植人 PBMC 和 SK-OV-3 卵巢癌细胞的小鼠接受 HER2–PCN 超声控 PATCH 后,肿瘤快速消退。
同时,治疗过程 未观察到全身炎症或器官毒性。免疫组化和单细胞转录组分析显示,PATCH 增加了肿瘤浸润的 CD4⁺/CD8⁺ T 细胞数量,提高效应/记忆 T 细胞比例,并显著降低终末耗竭 T 细胞表型(Pdcd1、Lag3、Tim3 等),表明 PATCH 可增强效应 T 细胞活性并防止耗竭。
进一步的,研究者还评估了 PATCH 是否能诱导持久的保护性记忆免疫。
在肿瘤再挑战实验中,曾被 PATCH 治愈的小鼠在无任何额外处理下再次接受肿瘤细胞攻击后,未处理小鼠出现快速肿瘤进展,而治愈组的所有小鼠在挑战中均完全抵御了肿瘤再次侵袭,验证了该技术在激发机体持久抗肿瘤免疫应答方面的作用。
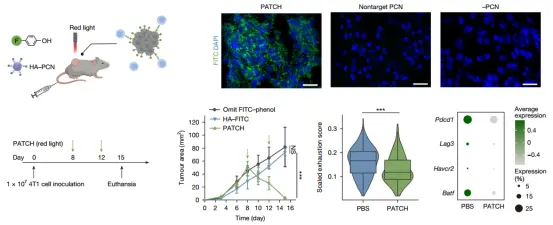
PATCH 在小鼠实体瘤模型中诱导 T 细胞激活和肿瘤清除
小结
综上,该研究团队首次证明邻近标记不仅能作为发现工具,还能通过在目标细胞表面空间可控地放大合成抗原,解决天然抗原密度不足的问题,从而有效激活 T 细胞快速清除肿瘤。相比传统方法,PATCH 具有三大优势:
①纳米酶催化放大生成高密度抗原簇,触发强效 TCR 聚集和免疫激活;
②空间特异性标记避免靶向毒性,拓展了可选择抗原范围,并具备深层组织应用潜力;
③可推广至 TCR 之外的其他受体激活,如 BCR 和 Fc 受体。
相比现有方法,PATCH 为抗原工程化和免疫治疗提供了新范式,未来有望在操控免疫受体功能和细胞状态方面得到广泛应用。
科研助力
目前,癌症免疫疗法主要有过继细胞疗法、免疫检查点阻断剂、非特异性免疫刺激和癌症疫苗等,大部分都是通过调节 T 细胞受体信号或使用天然的生物分子和相关肿瘤抗原的单克隆抗体刺激免疫系统的识别。
TargetMol 可为您提供 RRX-001 、Gemcitabine 、Ruxolitinib 等抗肿瘤 小分子/抗体/免疫检查点 助力相关研究,此外,我们的肿瘤免疫治疗小分子化合物库 ,包含523种靶向肿瘤免疫治疗靶点的小分子,可用于高通量和高内涵筛选,是研究肿瘤免疫治疗的有力工具;
其作用靶点包括PD-1/PD-L1, HER2, STAT3, CTLA4, IDO, STING, CCR, CXCR, TLR等;
有详细的说明书,化合物结构、靶点信息、活性描述等;
NMR、HPLC/LCMS等多种检测技术保证产品结构正确,纯度高,减少假阳性。
参考资料:
Li, S., Men, Y., Wang, Z. et al. Amplifying antigen-induced cellular responses with proximity labelling. Nature (2025). https://doi.org/10.1038/s41586-025-09518-6

其他文章

订阅TargetMol新闻
科学新闻、观点和分析的重要汇总,每个工作日都会发送到您的收件箱.




 |
|