 您的购物车当前为空
您的购物车当前为空

在复杂的肿瘤微环境中,免疫细胞不仅要面对癌细胞的攻击,还要在营养缺乏、氧气不足的环境里”生存作战“。其中,线粒体扮演着关键角色。它不仅为免疫细胞提供能量,更通过代谢调控它们的命运与功能。
以往研究发现,肿瘤浸润性T细胞的线粒体功能往往受损,导致“免疫疲劳”,但肿瘤相关巨噬细胞(TAMs)却能保持甚至增强线粒体活性,从而持续分泌免疫抑制信号,帮助肿瘤逃避免疫系统的清除。
近期,一项发表于 Nature Immunology 题为Cancer suooresses mitochondrialchaperone activity in macrophages to drive immune evasion 的论文次揭示了肿瘤如何通过抑制巨噬细胞线粒体分子伴侣的活性,从代谢与表观遗传两方面共同推动免疫抑制,从而实现免疫逃逸。这一发现为改善肿瘤免疫治疗效果提供了全新思路。

研究团队聚焦于一种名为TRAP1 (TNF Receptor–Associated Protein 1)的线粒体分子伴侣。由于目前关于TRAP1在免疫细胞中的研究仍十分有限,研究人员首先分析了其在不同免疫细胞类型中的表达谱。结果显示,TRAP1 缺失与肿瘤中的免疫抑制密切相关,无论在人类肿瘤还是小鼠模型中,TRAP1下调都会促进巨噬细胞的免疫抑制表型形成,提示TRAP1是调控肿瘤免疫微环境的重要代谢与免疫平衡因子。
进一步分析发现,TRAP1 缺失的巨噬细胞中(CD206、ARG1、CD301)的mRNA和蛋白表达明显升高,而促炎功能减弱。在Rag1⁻/⁻免疫缺陷小鼠模型中,TRAP1缺失促进了肿瘤生长,并显著增加肿瘤内的CD206⁺、ARG1⁺ TAMs数量。将Trap1⁻/⁻骨髓来源巨噬细胞(BMDMs)与肿瘤细胞共注射到野生型小鼠体内,可加速肿瘤生长,而TRAP1过表达则抑制该效应。
这些肿瘤伴随出现:
免疫抑制型TAMs浸润增加;
肿瘤浸润性淋巴细胞(TILs)减少;
IFNγ⁺ CD8⁺ T细胞频率降低;
调节性T细胞(Treg)比例升高。
重新过表达TRAP1可逆转上述免疫抑制表型,说明TRAP1可限制巨噬细胞的抑制性功能。
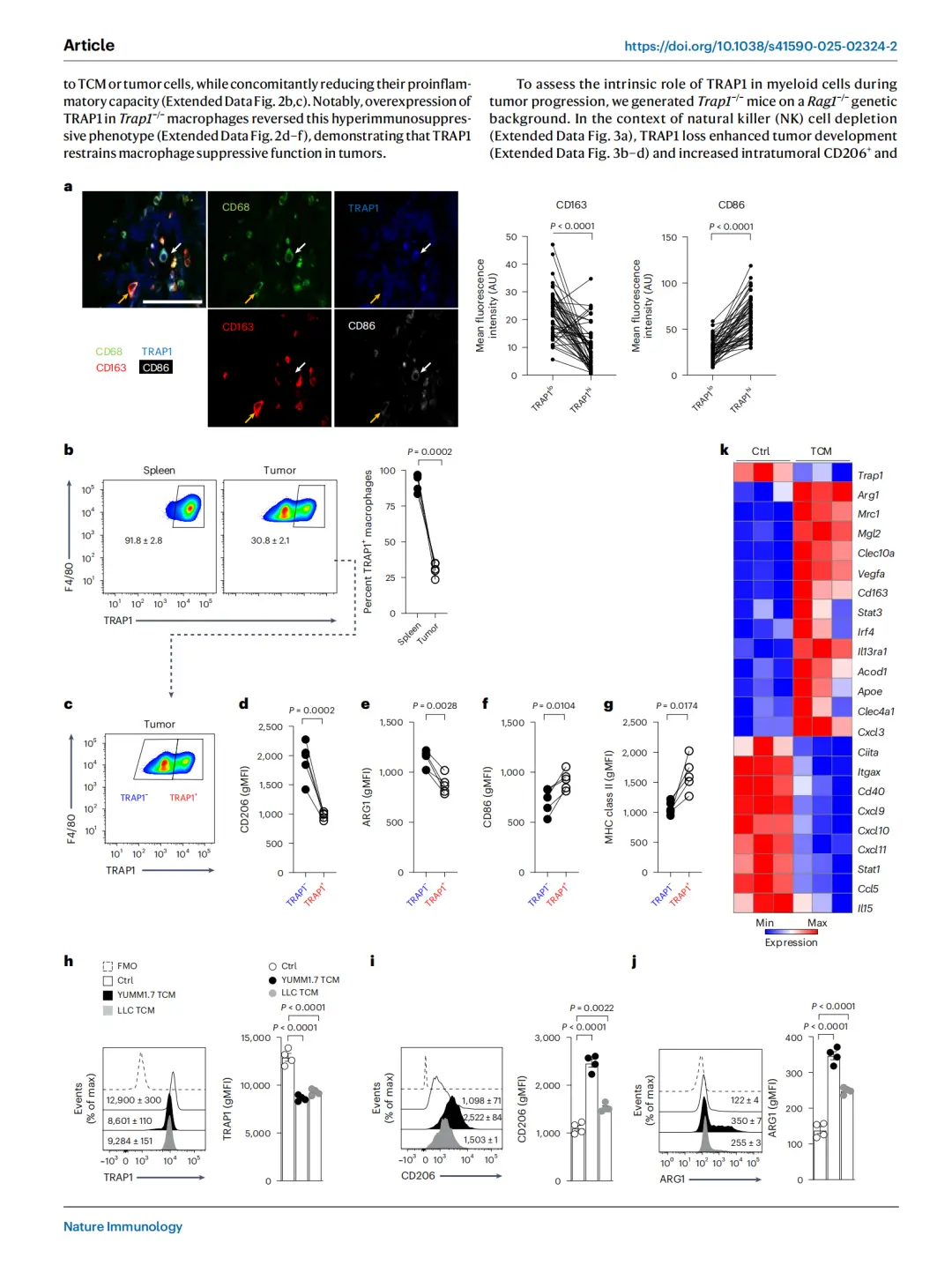
TRAP1的表达与人类及小鼠肿瘤中的巨噬细胞免疫抑制现象呈负相关
此外,在LysM-Cre; Trap1^fl/fl条件性敲除小鼠(Trap1^cKO)中,YUMM1.7黑色素瘤生长显著加快,肿瘤质量增加。其TAMs高表达免疫抑制分子(CD206、ARG1、PD-L1、PD-L2),低表达共刺激分子(CD86、MHC II);TIL数量减少,IFNγ⁺ CD8⁺及CD4⁺ T细胞比例下降,同时肿瘤内树突状细胞(特别是交叉呈递型DC1)减少。
TRAP1缺失同样加速Lewis肺癌(LLC)的生长,且显著缩短小鼠生存期。
功能共培养实验表明:Trap1^cKO来源的TAMs更强地抑制CD8⁺ T细胞的增殖及IFNγ、颗粒酶B(GZMB)产生。中性粒细胞去除实验证实,上述效应并非由TRAP1缺失的中性粒细胞导致。
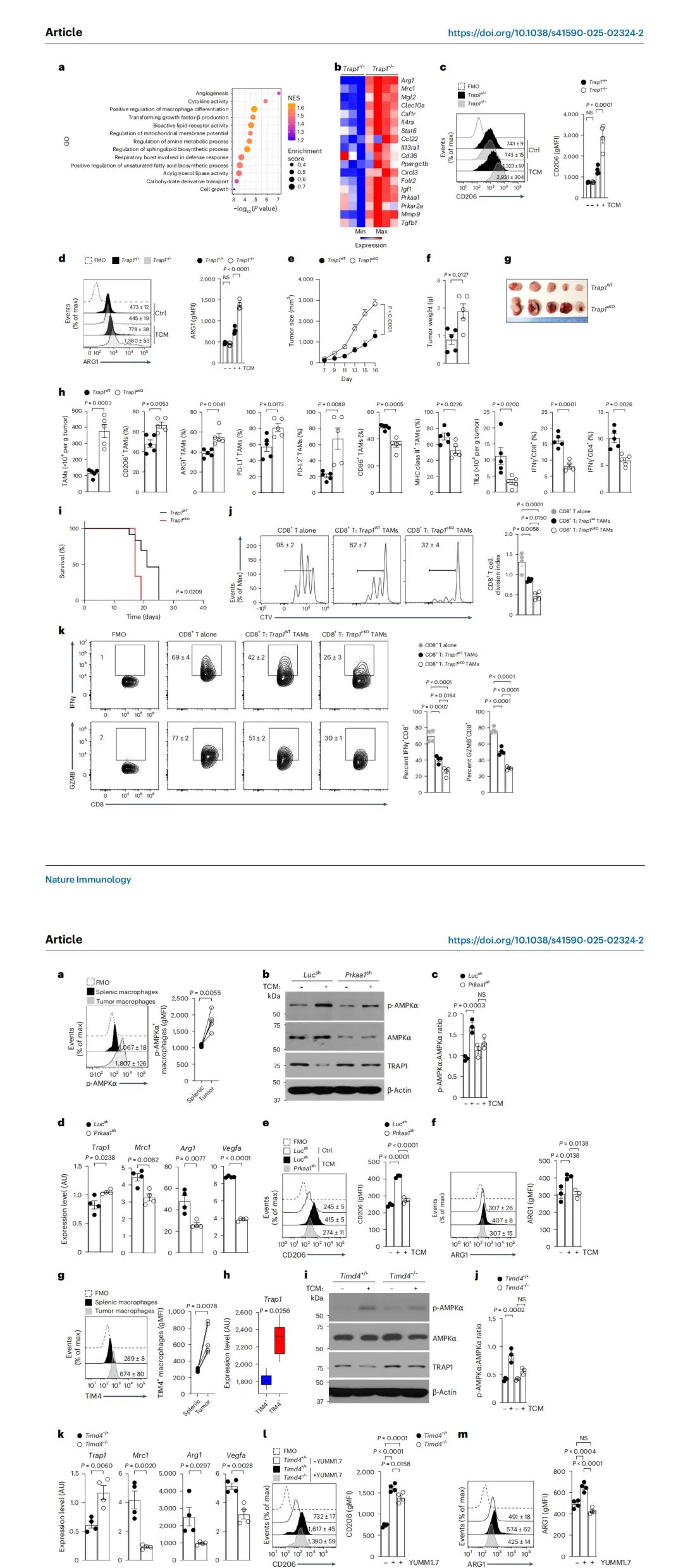
TRAP1确实会增强肿瘤相关巨噬细胞的免疫抑制活性和促进肿瘤逃逸
以上结果表明,TRAP1缺失导致巨噬细胞代谢与表型重编程,使其向高度免疫抑制的TAMs转化,从而削弱T细胞介导的抗肿瘤免疫反应,促进肿瘤免疫逃逸与生长。
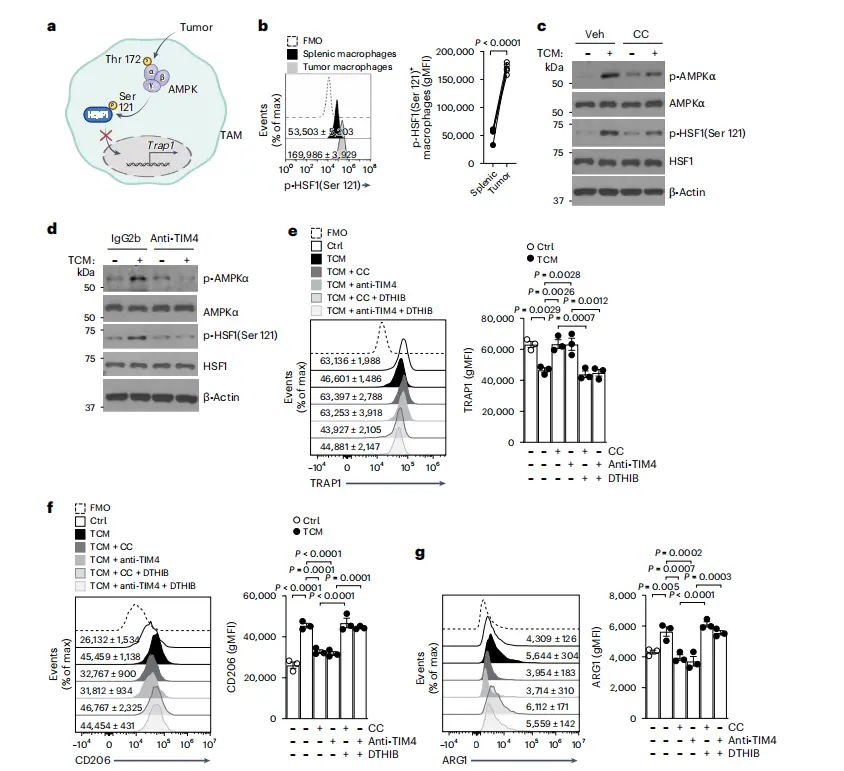
TIM4–AMPKα信号通路调节TAMs中的TRAP1表达
进一步的机制研究揭示,肿瘤通过一种独特的信号通路“关闭”TRAP1,即抑制HSF1的活性。
在肿瘤微环境(TME)中,巨噬细胞表面的TIM4受体通过与磷脂酰丝氨酸(PS)的结合,激活AMPK信号通路。一旦AMPK被激活,它会磷酸化并抑制热休克因子1(HSF1)的活性。HSF1本身是TRAP1转录的关键调控因子,激活HSF1能够促进TRAP1的表达。因此,当AMPK激活后,抑制了HSF1的功能,进而导致TRAP1的表达下降。当TRAP1水平下降时,巨噬细胞的线粒体呼吸增强,能量代谢更加旺盛,并积累代谢物α-酮戊二酸(α-ketoglutarate,α-KG)。α-KG可激活去甲基化酶JMJD3,促进组蛋白去甲基化,从而启动一系列免疫抑制相关基因的表达。

TIM4-AMPKα信号通路调控线粒体代谢
简单来说,肿瘤通过TIM4–AMPKα信号通路的激活来“关闭”TRAP1的表达,再利用α-KG-JMJD3通路重塑巨噬细胞的表观遗传状态,使其转化为免疫抑制型。TIM4的基因敲除或TIM4受体的阻断则能够显著减少AMPK的激活,从而恢复TRAP1的表达,抑制免疫抑制表型的形成。
研究还在体内评估了TIM4单克隆抗体和JMJD3抑制剂GSK-J4的治疗效果。在YUMM1.7黑色素瘤模型中,抗TIM4抗体和JMJD3抑制剂GSK-J4联合治疗不仅延缓了肿瘤生长,还减少了TAMs的免疫抑制活性,增加了肿瘤浸润的IFNγ产生的CD8+和CD4+ T细胞。此外,联合治疗还延长了肿瘤小鼠的生存期,并恢复了TAMs中的TRAP1表达,进一步强化了治疗效果。
然而,在TRAP1缺失的小鼠中,抗TIM4治疗无法恢复免疫抑制表型,证明TRAP1是TIM4信号通路下游的关键效应分子,且其在TAM免疫抑制分化中发挥不可替代的作用。这些结果表明,恢复TRAP1表达通过TIM4阻断和JMJD3抑制能够有效重塑肿瘤微环境,激活抗肿瘤免疫,为肿瘤免疫治疗提供了新的治疗策略。
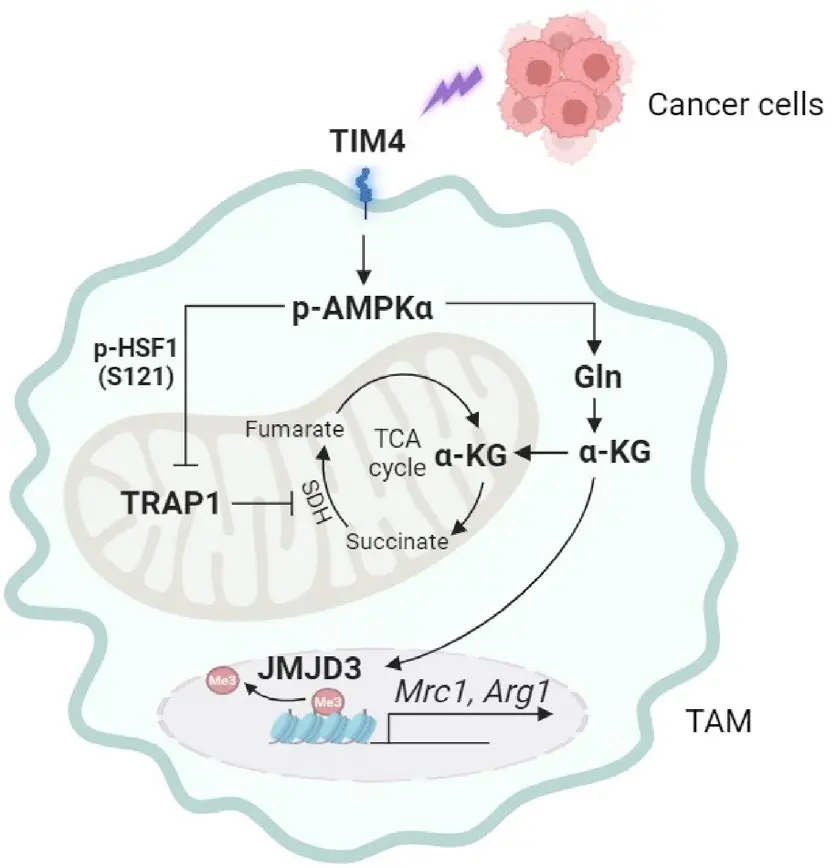
小结
综上,该研究发现TRAP1通过TIM4–AMPK信号通路调控TAMs的代谢和免疫抑制功能,在肿瘤免疫逃逸中发挥关键作用。联合靶向TRAP1信号通路,尤其是TIM4和JMJD3,可能成为一种有效的免疫治疗策略,旨在打破TAMs的免疫抑制状态,提升抗肿瘤免疫反应。
其他文章

订阅TargetMol新闻
科学新闻、观点和分析的重要汇总,每个工作日都会发送到您的收件箱.




 |
|