 您的购物车当前为空
您的购物车当前为空

KRAS 与 PI3KCA 是人类癌症中突变最频繁的基因之一。PI3KCA 基因编码的是磷脂酰肌醇3-激酶α(PI3Kα)蛋白,科学家早在30年前就已知突变的 RAS 和 PI3Kα 蛋白之间存在相互作用,这种相互作用是 驱动肿瘤生长 的重要信号通路的一部分。
但针对它的药物开发却面临诸多挑战,因为这两个蛋白之间的相互作用较弱,并且 PI3Kα 的靶向会 干扰正常的胰岛素信号通路,带来高血糖等副作用。
2025年6月12日,弗雷德里克国家癌症研究实验室(FNL)和 BridgeBio Oncology Therapeutics(BBOT)的研究团队于 Science 报道了一种名为 BBO-10203 的新型分子。
该分子通过共价结合方式阻断 RAS 与 PI3Kα 的相互作用,在多种小鼠肿瘤模型中,该药物显示出有效性,且最重要的是,它并不会影响胰岛素稳态,避免了高血糖副作用。

BBO-10203的开发
BBO-10203 的开发源于 FNL 的一个 RAS 研究计划。2019年,制药公司第一三共(Daiichi Sankyo)向该计划的负责人 Dhirendra Simanshu 博士团队提供了几种分子胶化合物,这些化合物可增强 RAS 与 PI3Kα 的结合。
通过这些分子,该团队首次解析了RAS-PI3Kα 复合物的结构。并通过后续的多轮优化,最终开发出了BBO-10203。
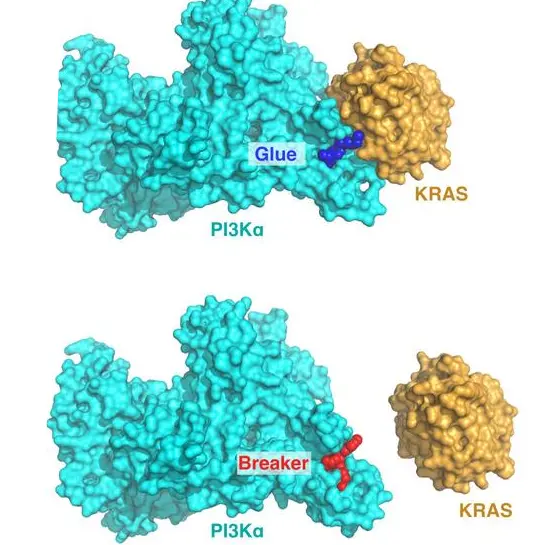
▲BBO-10203的开发策略。
一种分子胶(蓝色)可增强 KRAS(橙色)与 PI3Kα(青色)之间的相互作用,从而促进 KRAS 驱动的 PI3Kα 激活。通过结构导向设计,研究人员将该分子胶转化为一种“破坏者”分子(红色),其可破坏这种相互作用,阻断 KRAS 介导的 PI3Kα 致癌激活过程。

▲BBO-10203
BBO-10203的作用机制和效果
BBO-10203 能够选择性破坏 PI3Kα 与 KRAS 的相互作用,从而抑制 RAS 驱动的 PI3Kα 通路活性。
与应用于临床的 PI3Kα 抑制剂 alpelisib 对比显示,尽管 BBO-10203 不能完全抑制 AKT(因其作用限于 RAS 驱动的 PI3Kα),但其对 PI3Kα 的选择性和活性更高,且在 RNA-seq 和蛋白水平的下游信号改变上与 alpelisib(<1 µM)高度一致。
对比另一个 RAS 抑制剂 RMC-6236 的结果显示,在 HER2 扩增的细胞中,BBO-10203 能 完全抑制 pAKT,而RMC-6236主要针对经典的RAS蛋白(HRAS,NRAS,KRAS),在这些细胞中效果有限,说明 PI3Kα 的激活在这类细胞中可能依赖非经典的 RAS 蛋白。在 PI3Kα 有突变或 RAS 独立激活的细胞中,两药表现出部分抑制作用。此外,所有测试的细胞中,BBO-10203 都达到了良好的目标结合效果,证明其抗癌效果主要源于 对 PI3Kα 的高效选择性抑制。
更重要的是,BBO-10203 能强烈 干扰 PI3Kα 与 KRAS 的结合(IC50为3 nM),而当 PI3Kα 的 C242 位点突变成丝氨酸时,其结合能力大幅下降(IC50变为2000 nM),显示其作用的高度特异性和机制 依赖于该结合位点。
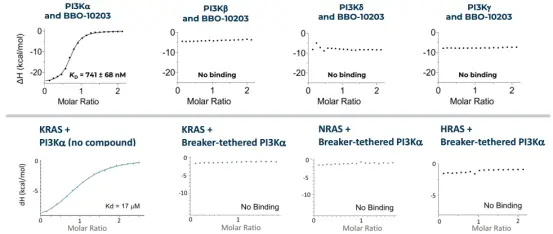
▲BBO-10203特异性结合PI3K的α亚型并破坏其与K-、H-和N-RAS的相互作用
体内靶标结合和对葡萄糖摄取的影响
对 BBO-10203 在体内的药代动力学特性、安全性及抗肿瘤疗效的评估表明,BBO-10203 在小鼠体内具有良好的口服生物利用度,其血药浓度随着剂量增加而线性上升。
具体而言:
在食管鳞状细胞癌的KYSE-410模型中,BBO-10203能够剂量依赖性地抑制pAKT的积累,从3到100 mg/kg,并在30和100 mg/kg剂量下持续24小时有效抑制,单次给药30 mg/kg可实现完全的靶点结合。此外,连续每日口服治疗在该模型中显示出剂量依赖的抗肿瘤效果,30 mg/kg剂量即能引起肿瘤回缩。相比之下,KRAS-G12C抑制剂sotorasib和HER2激酶抑制剂tucatinib在此模型中的效果有限,而PI3Kα抑制剂alpelisib在20 mg/kg剂量下仅达到了肿瘤稳定的效果。
与目前应用于临床的PIK3CA突变的激素受体阳性(HR+)、HER2阴性乳腺癌的alpelisib相比,alpelisib会引起显著的副作用,例如高血糖。而BBO-10203不会引起高血糖,这是因为胰岛素信号通路中的PI3Kα激活不依赖于RAS。在口服葡萄糖耐量测试中,使用alpelisib的老鼠表现出剂量依赖性血糖升高,而使用剂量为100 mg/kg(为有效剂量的3倍)的BBO-10203的老鼠则没有血糖和血清C肽升高,表明BBO-10203不会引发胰岛素相关的代谢副作用。
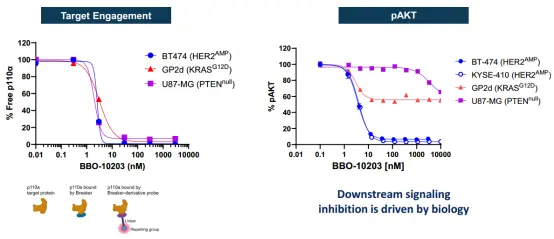
▲细胞内 pAKT 抑制程度的差异源于 RAS 激活 AKT 的能力
BB0-10203的抗肿瘤活性
BBO-10203 作为一种新型抗肿瘤药物,具有良好的口服生物利用度和显著的抗肿瘤活性。与多种标准治疗方案联合使用时,能够防止由pAKT驱动的耐药性,同时具有良好的耐受性。
例如,在 KYSE-410 食管鳞癌模型中,BBO-10203 单药即可实现肿瘤完全回缩,且无常见 PI3Kα 抑制剂(如 alpelisib)所导致的高血糖副作用。
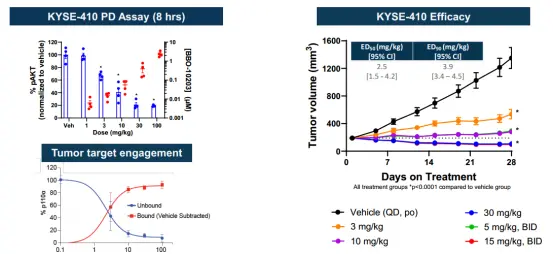
▲BBO-10203 在 KYSE-410(HER2 扩增/KRAS^G12C)CDX 模型中表现出强效的靶点结合能力和治疗效果
此外,BBO-10203 与多种标准靶向疗法联用(包括 HER2 抑制剂trastuzumab、ER拮抗剂fulvestrant、CDK4/6抑制剂palbociclib、KRAS-G12C抑制剂BBO-8520)可显著增强疗效,克服由 pAKT 活化所引起的耐药机制,并在多个异种移植小鼠模型中实现肿瘤停滞或缩小。
小结
综上,该研究报告了一种可有效阻断目前难以攻克的致癌信号通路——RAS-PI3K通路的新型药物——BBO-10203。
BBO-10203 具有良好的口服生物利用度和显著的抗肿瘤活性。与 KRAS 抑制剂联合使用时,能有效回缩对 KRAS 抑制剂单药无反应的肿瘤,特别是在伴随 KEAP1 或 STK11 突变的背景下。同样,BBO-10203 与 CDK4/6 抑制剂、ER 抗拮剂、HER2 抑制剂等药物联合时也显示出显著的抗肿瘤效果。
最重要的是,BBO-10203 在实现抗肿瘤作用的同时未引起明显毒性,尤其未诱发 PI3Kα 抑制剂常见的高血糖副作用。在 HER2 扩增型肿瘤中,BBO-10203 可完全抑制 PI3Kα 活性,揭示出依赖 PI3Kα 的关键生存通路,可能涉及非常规 RAS 蛋白。
目前,BBO-10203 已进入临床试验阶段,有望通过其差异化机制带来显著的临床益处,同时避免传统 PI3Kα 抑制剂的毒性限制。
科研助力
抑制 KRAS 的主要策略包括通过以下方式靶向其表面:
1)阻断RAS与其效应分子之间的相互作用。
2)将RAS捕获在非活性构象中,阻止效应分子结合和信号传导。
3)共价抑制剂分子与新发现的switch-II口袋相互作用。
2019年,多种化合物进入临床试验,包括:安进的 AMG 510 ,Mirati Therapeutics的MRTX849 ,强生的 JNJ-74699157 (ARS-3248)。
近期进展中,开发了能够结合 SI/II 口袋的小分子,该口袋存在于 KRAS 的活性和非活性形式中。这些化合物抑制 GTP 结合的 KRAS 与 SOS1 变构位点及其效应分子(如CRAF和PI3Kα)之间的相互作用。值得注意的是,基因泰克和其他研究团队发现了靶向KRAS switch I和II区域之间浅口袋(SI/II口袋)的分子。
TargetMol 提供 KRAS靶向化合物库 ,该库包含16,000种分子,助力相关研究的开展,欢迎私信咨询~

参考资料:
[1] https://www.science.org/doi/10.1126/science.adq2004
[2] https://www.businesswire.com/news/home/20250612982572/en/BBOT-Announces-Publication-in-Science-Highlighting-Preclinical-Data-that-Supports-the-Potential-for-RASPI3K-Breaker-BBO-10203-to-Provide-Therapeutic-Benefit-across-Multiple-Tumor-Types
[3] https://frederick.cancer.gov/news/drug-blocking-cancer-driving-ras-pi3k-pathway-enters-clinical-trials
[4] https://aacrjournals.org/cancerres/article/84/9_Supplement/RF02-02/743304/Abstract-RF02-02-BBO-10203-a-first-in-class-orally
[5] https://www.dana-farber.org/clinical-trials/24-514
[6] https://ichgcp.net/zh/clinical-trials-registry/NCT06625775
其他文章

订阅TargetMol新闻
科学新闻、观点和分析的重要汇总,每个工作日都会发送到您的收件箱.




 |
|