 您的购物车当前为空
您的购物车当前为空
Nature :开发基于STING激动剂的ER靶向分子促进抗原交叉呈递技术

恭喜我司客户 Nature 新成果:开发基于STING激动剂的ER靶向分子促进抗原交叉呈递技术!
抗原交叉呈递是指外源性抗原(如肿瘤细胞碎片或病毒颗粒)在被摄取后,经过加工通过组织相容性复合体 I 类(MHC I )分子呈递给 CD8⁺ T 细胞,从而诱导细胞毒性 T 细胞免疫应答的过程。这一机制也是 癌症免疫疗法 和 传染病疫苗 的核心途径。
要想激活强效的 CD8⁺ T 细胞免疫应答,提升抗原的MHC I 呈递效率 是关键。因此,开发高效的内质网靶向分子,以精准调控抗原从胞质向内质网(ER)的递送路径,从而显著增强交叉呈递效率是当前研究的热点之一。
2025年3月26日,中山大学王骥、复旦大学陆路、辽宁大学曾颖玥等多个团队联合在 Nature 发表了题为“STING agonist-based ER-targeting molecules boost antigen cross-presentation”的研究论文。该研究开发了基于STING激动剂的高亲和力ER靶向分子(SABER),实现了抗原的高效ER靶向,研究中使用了 TargetMol 的diABZI 、H151 噢,大咖的选择,值得信赖!

新型ER靶向分子——SABER
该团队通过筛选定位于内质网表面的蛋白质,确定了 STING 蛋白作为靶点,并通过对多种 STING 激动剂(如 cGAMP、c-diGMP 和 diABZI 等)的晶体结构进行分析、优化,最终开发出一系列 SABER (STING agonist-based ER-targeting molecules) 分子。
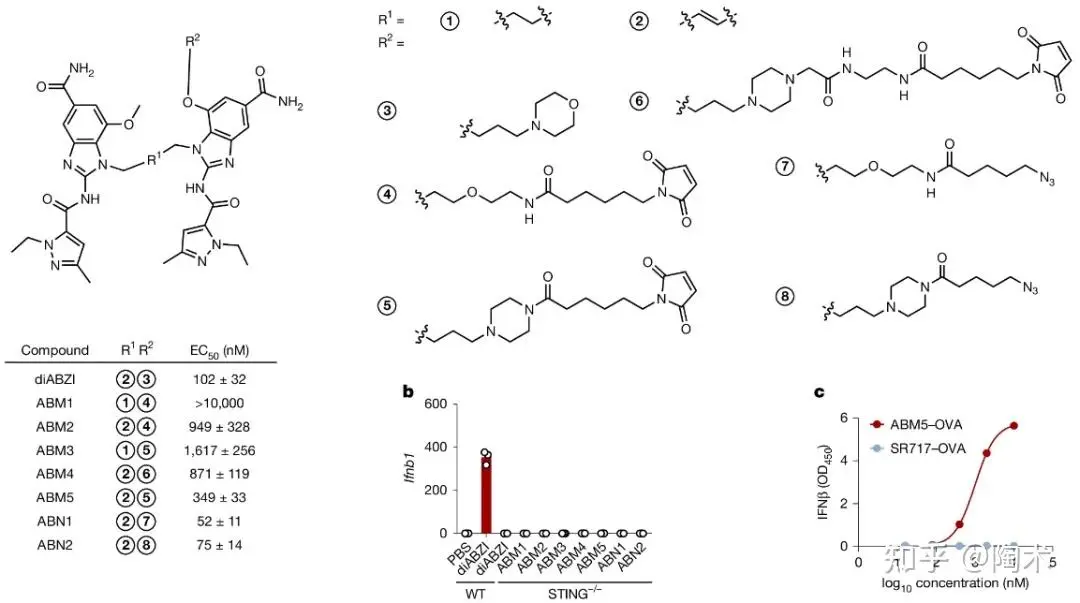
▲SABER家族化合物及diABZI的化学结构
该类分子兼具 双重功能:① 通过偶联表位多肽将抗原靶向内质网,富集交叉提呈相关酶,提升提呈效率;② 同时保留 STING 激动剂活性,增强先天免疫系统。
研究者选取其中的 ABM5 作为代表性分子, 并将其 与模式抗原(如 OVA)偶联,构建了 ABM5–OVA 复合物用以 模拟肿瘤新抗原疫苗的临床情境,并评估其在抗原交叉呈递中的能力。实验证实:
• ABM5–OVA 保留了 STING 激动能力,且其免疫活性依赖于 STING 信号通路;
• 与传统 STING 激动剂 + 抗原混合物相比,ABM5–OVA 显著增强了抗原的交叉呈递效果;
• ABM5–OVA 能有效激活树突状细胞、促进 CD8⁺ T 细胞应答,且即使在低剂量下也保持高效;
• 此策略对强弱抗原表位均有效,具有广泛适应性。
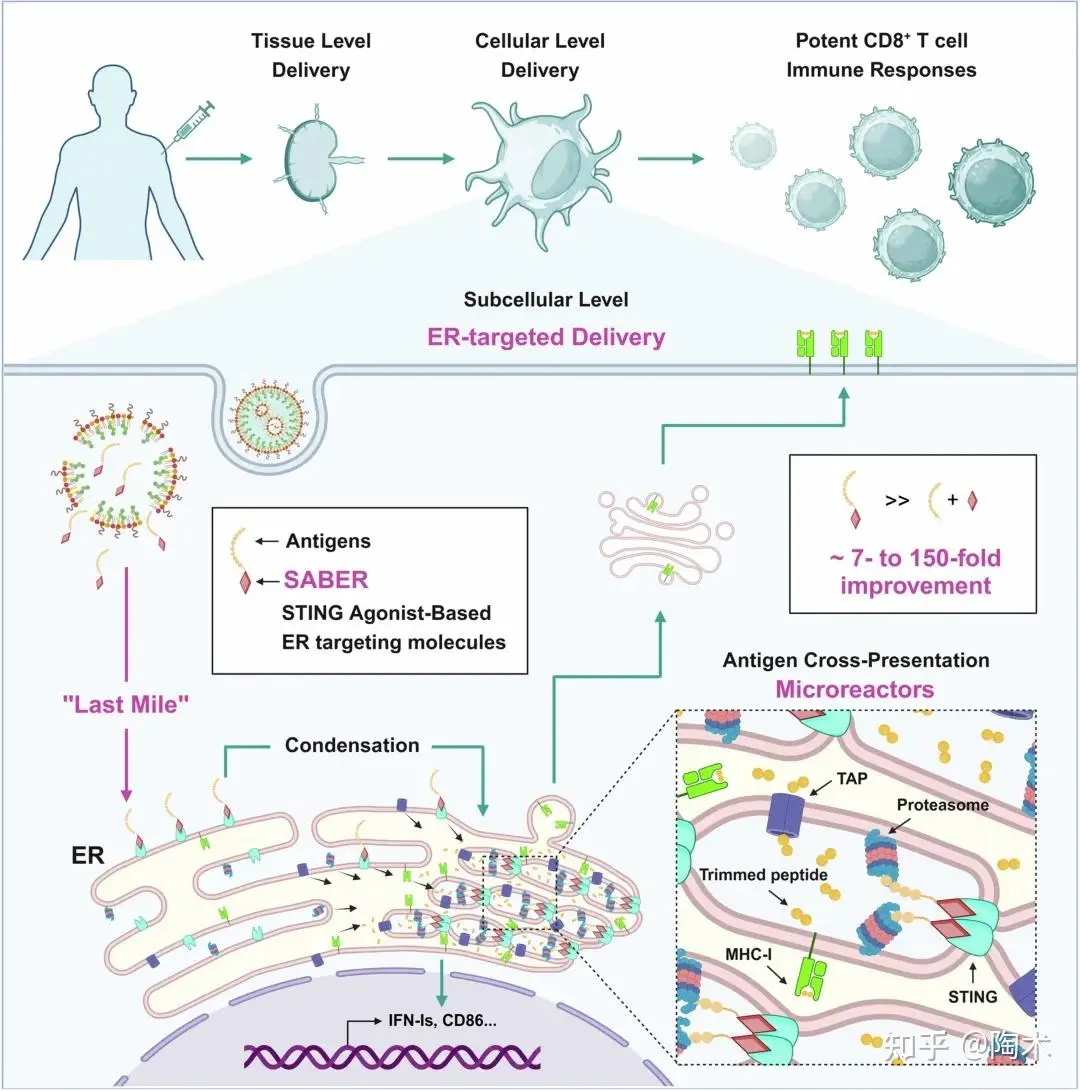
▲SABER 可高效将抗原递送至内质网,并聚集交叉提呈关键分子形成“微反应器” 示意图
SABER(STING激动剂偶联抗原)增强交叉呈递的机制在于:它能通过折叠ER膜诱导 “微反应器” 形成,有效聚集抗原呈递所需的关键组分。具体要点包括:
• SABER诱导微反应器形成:在接受 ABM5–OVA(SABER偶联物)处理的树突状细胞中,STING、TAP1 及蛋白酶体等交叉呈递关键组分被富集,形成类似“微反应器”的结构。
• 增强抗原处理效率:这些微反应器在局部空间内加速抗原肽的裂解和转运,显著提高交叉呈递效率。
• 机制不同于传统STING激动剂:SABER偶联物激活 STING 的速率较慢,允许其在内质网上聚集而非快速进入高尔基体,从而促进微反应器的形成。
总的来说,SABER 通过空间定位和动力学优化,使交叉呈递的关键机制高度局部化,从而提升了抗原呈递效率和后续的免疫反应。
提升肿瘤&传染病疫苗免疫效果
研究还通过肿瘤疫苗和传染病疫苗两种模型,证明了 SABER 疫苗(如ABM5–OVA)表现出远超传统 STING激动剂+抗原组合的预防和治疗效果,不仅能诱导高水平的 OVA 特异性 CD8⁺ T 细胞,还能实现肿瘤完全清除与长期生存保护。
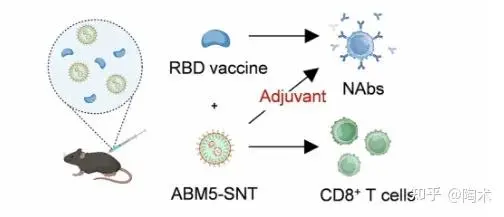
▲SABER 增强抗肿瘤和抗病毒免疫反应
肿瘤疫苗
针对 ABM5-OVA 二次免疫后的小鼠进行表达 OVA 的黑色素瘤(B16-OVA)接种研究表明,ABM5-OVA 疫苗显著抑制肿瘤生长并使全部小鼠存活;而对照疫苗 iABZI+OVA 仅轻度抑瘤,90%小鼠5周内死亡。
进一步的,研究者验证了 SABER 偶联真正的肿瘤抗原的效果。通过将 ABM5 与肿瘤新生抗原Adpgk 偶联并封装入 LNP 制成疫苗,小鼠免疫实验显示,ABM5-Adpgk 诱导出强效且特异的 CD8⁺ T 细胞应答,其水平较模拟疫苗和 diABZI+Adpgk 疫苗分别高 150 倍和 7 倍,且 90 天后仍然无瘤。
传染病疫苗
针对 SARS-CoV-2 的疫苗研究表明,SABER–抗原偶联物(如ABM5–SNT)可显著增强 CD8⁺ T 细胞应答,有效降低小鼠体内病毒载量(约100倍),并诱导强效的干扰素-γ 表达。
此外,ABM5–SNT 还可作为佐剂协同次单位疫苗(如RBD-Fc),增强抗体产生和交叉中和抗体水平,尤其对不匹配毒株(如BA.1和BA.5)亦具有提升效果。
SABER 的优势在于其可 有效促进抗原呈递并激活细胞与体液免疫,优于现有多种佐剂(如diABZI、poly-I:C、ODN1018、ISCOMs),为开发泛冠状病毒、流感及个性化肿瘤疫苗提供了极具潜力的策略。
小结
综上,该研究开发了一类基于 STING 激动剂的小分子ER靶向递送体系SABER,突破性地实现了抗原在树突状细胞内“从胞质到内质网”这一抗原交叉呈递“最后一英里”的精准递送。
SABER可诱导 ER 膜折叠并形成富集交叉呈递关键分子的“微反应器”,显著增强肿瘤新抗原和病毒保守表位的 CD8⁺ T 细胞免疫应答,效能远超传统佐剂或抗原与 STING 激动剂的混合物。
同时,SABER 亦保留强效佐剂作用,可提升次单位疫苗的广谱中和抗体水平,展示了亚细胞水平精准递送对疫苗免疫质量的根本性提升。
科研助力
抗病毒化合物的开发是医学和科学领域的关键前沿。面对新型冠状病毒、HIV、流感和丙型肝炎病毒(HCV)等新兴和再现的病毒威胁,对有效抗病毒疗法的需求从未如此紧迫。
TargetMol 抗病毒筛选化合物库 包含87,000种化合物,适用于病毒机制和发病机制的研究,这些化合物在管理和治疗感染、降低死亡率以及改善全球数百万人的生活质量方面发挥着关键作用。

往期推荐
• JAK 抑制剂联合疗法三期临床结果出炉,疗效 & 安全性俱佳!
• 新发现!铜螯合剂 TETA 治疗可帮助削弱肿瘤并增强免疫系统,使癌症治疗成功率提升 40% !
• Breaking News ! TargetMol 官网全面升级,全方位提升您的使用体验!
• Science 重磅!降解 13 种 KRAS 突变体,效力提升 10 倍!
• 盘点: 2024 前三季度 FDA 批准的 34 款新药
原文链接:
https://www. nature.com/articles/s41 586-025-08758-w#Abs1
其他文章

订阅TargetMol新闻
科学新闻、观点和分析的重要汇总,每个工作日都会发送到您的收件箱.




 |
|