 您的购物车当前为空
您的购物车当前为空

常见的 KRAS 突变类型是G12C(35%)、G12V(18%)、G12D(13%)、G12A(6%)、Q61H(4%)和G13D(4%)。不同KRAS突变在癌种间分布差异显著,如G12D在胰腺癌(42%)和结肠癌(30%)中最常见,而G12C则在肺癌中最常见(40%)。这种突变类型的差异性也说明针对特定 KRAS 突变开发靶向治疗具有重要临床价值 。
2025年6月19日,北卡罗来纳大学Chad V. Pecot教授领导的研究团队于 Cancer Cell 报道了一种表皮生长因子受体(EGFR)导向的小干扰RNA(siRNA)偶联物——EFTX-G12V。该分子通过结合RNA干扰(RNAi)技术与肿瘤靶向配体,在多种癌症模型中展现出显著的抗肿瘤效应。

EFTX-G12V 的开发
KRAS G12V 虽是临床中第二常见的 KRAS 突变类型,但至今仍没有针对性的抑制剂进入临床应用。
此前,该团队已利用一段工程化的人工 KRAS mRNA 序列,设计出了可特异性靶向 KRAS G12C 、KRAS G12V 和 KRAS G13D 突变的未修饰 siRNA,在此基础上,他们进一步设计了三种完全修饰的 KRAS G12V 特异性 siRNA 分子。
通过对这三种分子进行筛选评估并进行优化,研究者确定了一种 2'-O-甲基修饰的版本(Hi2OMe)。该 siRNA 在多种 KRAS G12V 突变癌细胞系中有效抑制细胞增殖、肿瘤球形成和 KRAS 蛋白表达,并显著降低下游 MAPK 信号通路的活性,同时几乎完全保留KRAS WT 表达(<5%抑制),展现出高度特异性。
热力学和结构分析表明,该 siRNA 的突变选择性源于其与 KRAS G12V mRNA 的特异性结合,这种结合由反义链第5位的单核苷酸错配所介导。
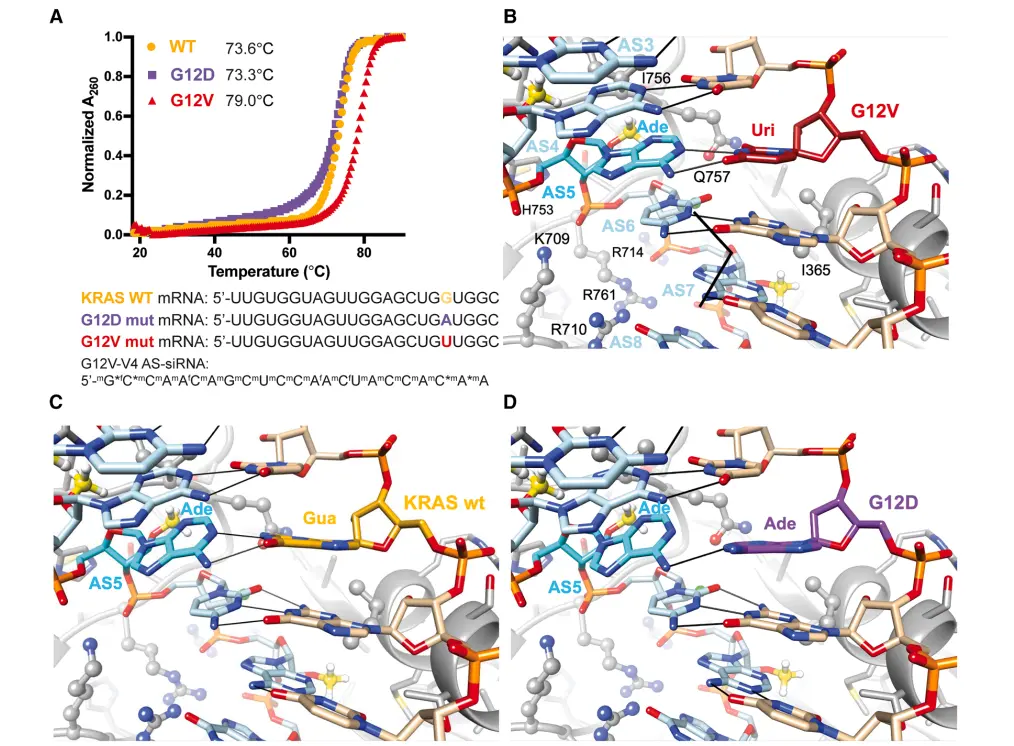
▲KRAS siRNA引导链与mRNA模拟双链体的热稳定性与结构
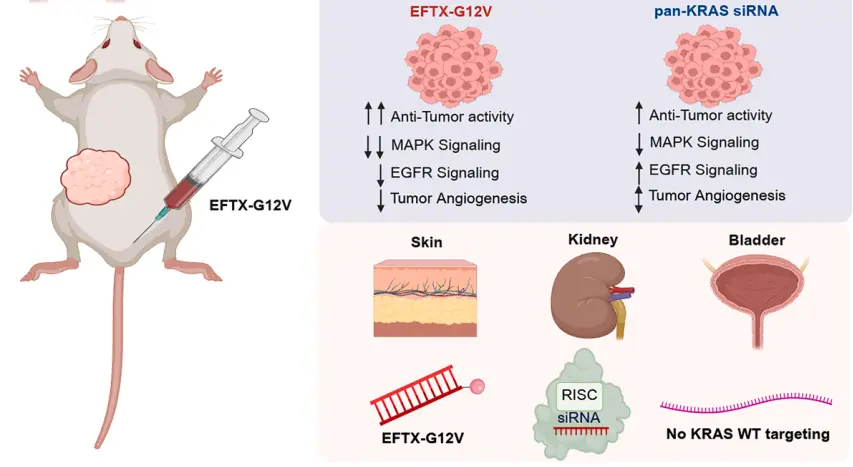
随后,研究者结合癌细胞系百科(CCLE)数据分析的结果——即表皮生长因子受体(EGFR)在多种 KRAS 癌症类型中高表达,他们将 EGFR 结合肽(GE11C)与特异性靶向 KRAS G12V 的 siRNA 偶联起来,从而构建了 EGFR 导向的、高度特异性的 RNAi 分子——EFTX-G12V。
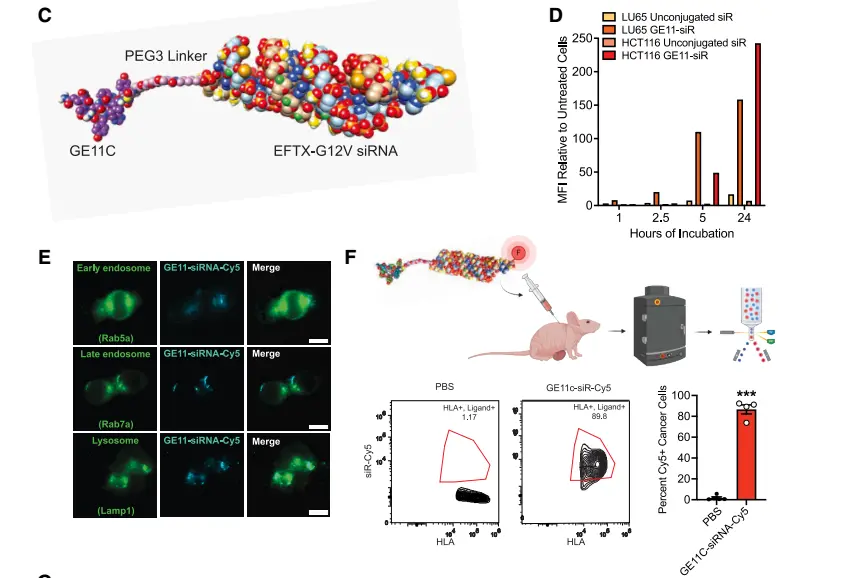
▲GE11C介导的siRNA递送及EGFR表达的表征
EFTX-G12V 的抗肿瘤活性
体外实验及小鼠实验的结果显示:
1)EFTX-G12V具有广谱抗肿瘤活性
• EFTX-G12V在四种EGFR表达中等的KRASG12V突变肿瘤模型(肺癌H727、H441,结直肠癌SKCO1,胰腺癌Capan-2)中表现出显著优于pan-KRAS siRNA的肿瘤抑制效果。
• H727模型中,EFTX-G12V比pan-KRAS有更强抑瘤作用(82% vs. 60%),且在H441模型中,pan-KRAS完全无效,而EFTX-G12V抑瘤率达73%。
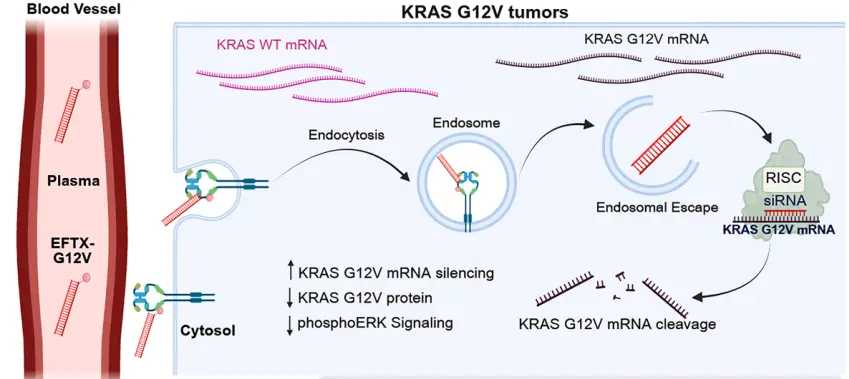
▲研究示意图
2)EFTX-G12V给药频率灵活,效果稳定
在SKCO1模型中,每周一次给药的EFTX-G12V疗效可与每周两次pan-KRAS相媲美,而每周两次给药的EFTX-G12V疗效最强,多次给药后未观察到EGFR表达降低。
3)EFTX-G12V 分子机制优势
• EFTX-G12V比pan-KRAS更持续抑制MAPK通路(pERK)与EGFR信号(pEGFR);
• EFTX-G12V还能明显抑制Hippo通路关键因子YAP的磷酸化(pYAP-S127),提示可能克服YAP介导的KRAS抑制耐药性;
• RTK再激活在pan-KRAS组中频繁出现,提示其疗效受限,而EFTX-G12V组保持较长时间的通路抑制。
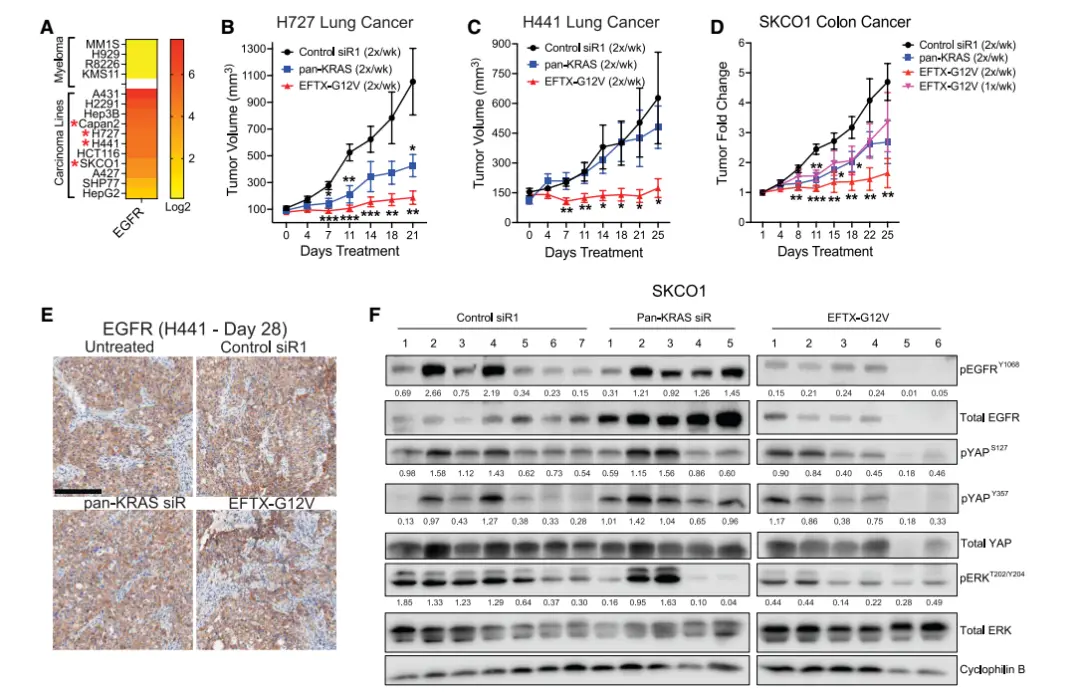
▲GE11C结合的EFTX-G12V siRNA在肺和结肠异种移植模型中的疗效
此外,在免疫正常小鼠中进行的初步安全性研究结果显示,EFTX-G12V 不会影响行为、体重、器官质量、骨髓及肝肾功能,也未诱导炎症反应。miRNAscope 技术证实其在体内广泛分布,尤其富集于皮肤、肾脏、肝脏和膀胱壁。尽管在肾小管可见轻微细胞质嗜碱性变化和微弱空泡形成,但未见组织学损伤或毒性迹象。
小结
综上,该研究通过结合靶向配体与化学修饰 siRNA 的策略,成功开发出一种以 EGFR 为靶点的 RNAi 药物(EFTX-G12V)。该药物在多种癌症模型中实现了对 KRAS G12V 突变的高效且特异性沉默,并显著抑制了肿瘤生长,首次验证了针对 KRASG12V 突变的精准 RNAi 治疗的可行性,为 KRAS 突变型癌症的治疗开辟了新的方向与可能。
科研助力
抑制 KRAS 的主要策略包括通过以下方式靶向其表面:
1)阻断Ras与其效应分子之间的相互作用。
2)将Ras捕获在非活性构象中,阻止效应分子结合和信号传导。
3)共价抑制剂分子与新发现的switch-II口袋相互作用。
2019年,多种化合物进入临床试验,包括:安进的AMG 510 ,Mirati Therapeutics的MRTX849 ,强生的JNJ-74699157 (ARS-3248)。
近期进展中,开发了能够结合SI/II口袋的小分子,该口袋存在于KRAS的活性和非活性形式中。这些化合物抑制GTP结合的KRAS与SOS1变构位点及其效应分子(如CRAF和PI3Kα)之间的相互作用。值得注意的是,基因泰克和其他研究团队发现了靶向KRAS switch I和II区域之间浅口袋(SI/II口袋)的分子。
TargetMol提供KRAS靶向化合物库 ,包含16,000种分子,助力相关研究的开展,欢迎私信咨询

原文链接:
https://www.cell.com/cancer-cell/fulltext/S1535-6108(25)00225-9#author -highlights-abstract
其他文章

订阅TargetMol新闻
科学新闻、观点和分析的重要汇总,每个工作日都会发送到您的收件箱.




 |
|