 您的购物车当前为空
您的购物车当前为空

细胞程序性坏死,又称坏死性凋亡(necroptosis),是一种受遗传程序调控的溶解性细胞死亡方式,广泛参与多种炎症性疾病和退行性疾病的发生与发展。该过程通常由凋亡信号通路中的关键分子启动,如 TNF-α,通过 RIPK1 和 RIPK3 的激活,最终导致 MLKL 的磷酸化和细胞膜的破裂,从而引发细胞死亡。
2025 年 7 月 3 日,北京生命科学研究所/清华大学生物医学交叉研究院王晓东院士团队在 Molecular Cell 杂志发表最新研究成果,首次揭示坏死性凋亡不仅通过释放损伤相关分子模式(DAMPs)激活邻近细胞,诱发非细胞自主性炎症,还可通过诱导线粒体 DNA(mtDNA)释放,激活 cGAS–STING 通路,从而以细胞自主性机制启动炎症反应。
该发现不仅拓展了我们对坏死性凋亡炎症机制的理解,也为炎症性肠病(IBD)等疾病的治疗提供了新的理论依据和潜在干预靶点。值得一提的是,研究中所用的小分子抑制剂 TC13172 和 Vincristine sulfate 均来自 TargetMol,大咖的选择,值得信赖!

新发现
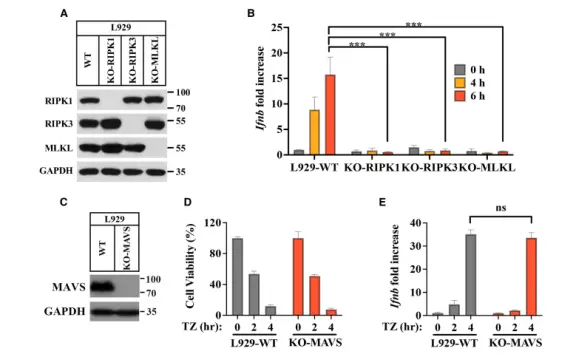
在这项最新研究中,研究人员为了探索细胞对程序性坏死信号的反应,在小鼠 L929 细胞中使用 TNF-α 和 Z-VAD-fmk (TZ)诱导细胞死亡,意外发现坏死过程中I型干扰素表达上调,其中 Ifnb(干扰素β)上升最为显著。随后通过敲除 RIPK1、RIPK3 和 MLKL 等关键坏死信号分子,研究证实 Ifnb 的表达依赖典型的坏死通路。
这一发现在其他细胞系中也得到了验证,如小鼠 iBMDM 细胞和外源表达 RIPK3 的人源 HeLa-RIPK3 细胞。特别是在 HeLa-RIPK3 细胞中,Ifnb在坏死早期(处理后1小时)即显著上调,此时细胞尚未出现膜破裂或死亡,说明该表达是细胞自主的早期响应。
▲程序性坏死诱导cGAS依赖性I型干扰素表达
为探究介导 Ifnb 表达的信号通路,研究者分别敲除了 RIG-I/MDA5-MAVS(识别胞质dsRNA)和 cGAS-STING(识别胞质dsDNA)两条关键的先天免疫通路的核心基因。结果表明,缺失 MAVS 不影响 Ifnb 表达;而缺失 cGAS、STING 或其下游激酶 TBK1,或使用 STING 抑制剂 H-151 处理,均显著抑制了 Ifnb 表达,但不影响坏死本身的发生和 MLKL 磷酸化的产生。
这些结果表明,程序性坏死可诱导细胞自主性地表达 Ifnb,该过程依赖 cGAS-STING 通路,而非 RIG-I/MDA5-MAVS 通路。
mtDNA 是激活 cGAS-STING 通路的关键分子信号源
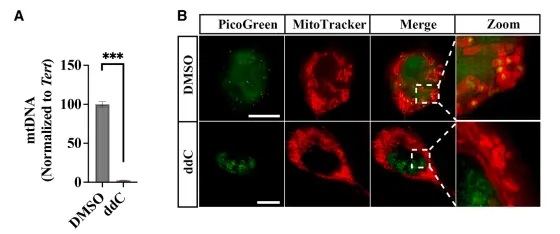
接下来,研究者为探究程序性坏死中激活了 cGAS 的 DNA 来源,从正在发生坏死的细胞中分离出胞质组分,检测发现,坏死诱导后胞质中 线粒体 DNA(mtDNA)水平显著上升,而核DNA无显著变化。
免疫荧光结合超分辨成像显示,诱导程序性坏死后,mtDNA 从线粒体内部移出至线粒体外或限制于线粒体外膜。在线粒体 DNA 缺失的细胞中,程序性坏死仍能发生,但由于缺乏胞质游离 mtDNA,Ifnb 表达被抑制。表明了 mtDNA 的释放是激活 cGAS-STING 通路并诱导 Ifnb 表达的必要条件。
▲Ifnb 表达依赖于胞质中的线粒体 DNA(mtDNA)
mtDNA的释放途径
mtDNA 释放的可能途径包括线粒体通透性转换孔(mPTP)、VDAC寡聚化孔、Gasdermin 家族蛋白或 Bax/Bak 等。
但在该研究中,研究者首先发现,使用半胱天冬酶抑制剂 Z-VAD-fmk 可有效阻断 Gasdermin 的活化,排除了焦亡中 Gasdermin 介导的 mtDNA 释放机制。其次,坏死诱导下 TFAM、EndoG 和 cytochrome c 等蛋白表达未发生变化,且 mPTP 和 VDAC 抑制剂无法阻断 mtDNA 释放,说明 mPTP/VDAC 通路未参与。
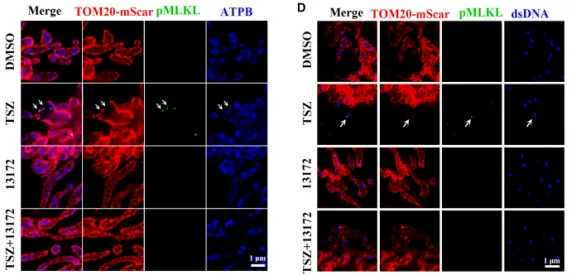
此外,Bax/Bak 双缺失细胞在坏死诱导下仍可释放 mtDNA 并发生细胞死亡,而 MLKL 缺失则完全阻断这一过程,进一步排除 Bax/Bak 在坏死相关mtDNA释放中的作用。最终,研究人员确定 寡聚的 pMLKL 是执行 mtDNA 释放的关键。
使用 TargetMol 的 pMLKL 寡聚化抑制剂 TC13172 可抑制 mtDNA 释放。在线粒体膜开口处也观察到了 pMLKL 的共定位。在纯化的线粒体组分中检测到 pMLKL 富集。线粒体膜富含带负电的心磷脂,而 MLKL 对心磷脂具有高亲和性。PLSCR3 是负责将心磷脂从线粒体内膜转运至外膜的翻转酶,其缺失可抑制程序性坏死导致的 mtDNA 释放。
▲磷酸化 MLKL 在程序性坏死过程中使线粒体膜通透化
研究还发现这个 mtDNA 释放过程是可调控的。在程序性坏死中,mtDNA 的释放可被微管破坏剂(如秋水仙碱 、D-64131 和长春新碱 )显著抑制,但微管稳定剂(如10-deacetyltaxol )无此效应。
这些药物不会影响坏死过程本身,也不干扰线粒体形态或磷酸化 MLKL 在坏死时定位到线粒体的能力,而是 阻断了 mtDNA 从线粒体进入胞质的过程,显著减少胞质中 mtDNA 的数量。这表明微管完整性在 mtDNA 跨膜释放中发挥关键作用,可能参与了 mtDNA 从线粒体向胞质的转运机制。
疾病模型验证
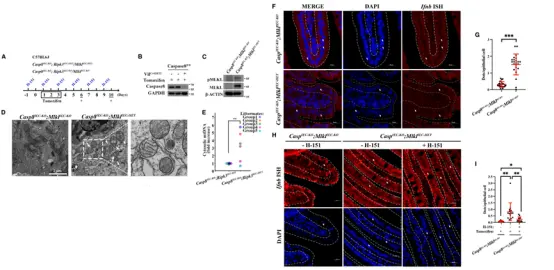
为了验证程序性坏死过程中 mtDNA 释放及其激活 cGAS 的现象是否也在体内发生,研究人员构建了坏死驱动型炎症性肠病(IBD)小鼠模型,探究 mtDNA-cGAS-STING 通路在疾病中的作用。
结果发现,仅在 MLKL 存在的小鼠肠上皮细胞中观察到明显的磷酸化 MLKL 信号,而 MLKL 缺失的小鼠中则完全缺乏该信号。组织学和共聚焦分析显示,MLKL 缺失可显著改善肠道上皮结构紊乱、线粒体肿胀和形态紊乱等坏死表型。
▲抑制 MLKL-mtDNA-cGAS-STING 通路可减轻 IBD 小鼠的炎症反应
进一步的透射电镜观察发现,坏死型 IEC(肠上皮细胞)中的线粒体呈现断裂、水肿和内膜、外膜破裂现象,同时胞质中 mtDNA 显著升高,仅出现在存在 RIPK3 /MLKL 的坏死模型小鼠中。核 DNA 水平则无明显变化。
RNA 原位杂交和免疫组化结果显示,坏死小鼠肠道组织中 Ifnb 表达和干扰素刺激基因(如IFI44)显著上调,并伴随中性粒细胞浸润(MPO染色阳性)和杯状细胞减少(MUC2染色阳性细胞减少)。上述炎症表型在 STING 抑制剂 H-151 处理后得到明显缓解,说明 炎症与mtDNA激活cGAS-STING通路密切相关。
小结
坏死性凋亡(Necroptosis)是一种促炎性的裂解型细胞死亡形式,由类混合谱系激酶样蛋白(MLKL)这一假激酶执行。在多种炎症信号诱导下,MLKL 被受体相互作用丝/苏氨酸蛋白激酶3(RIPK3)磷酸化,并从胞质转移至质膜,引发膜破裂并释放损伤相关分子模式(DAMPs)。
该研究发现,磷酸化后的 MLKL 还会转移至线粒体,诱导依赖微管的线粒体 DNA(mtDNA)释放。释放的 mtDNA 激活 cGAS–STING通路,从而上调干扰素β(Ifnb)表达。
在坏死性凋亡驱动的炎症性肠病(IBD)小鼠模型中,阻断 cGAS–STING 通路可有效减轻炎症并促进肠道修复。因此,MLKL 可通过两种机制介导炎症:一是非细胞自主性机制,即释放 DAMPs 激活邻近细胞;二是细胞自主性机制,即引发 mtDNA 外泄并激活 cGAS–STING 通路,直接在死亡细胞内部触发炎症反应。该研究深化了我们对程序性坏死的理解,并对IBD治疗具有积极意义。

原文链接:
https://www.cell.com/molecular-cell/abstract/S1097-2765(25)00505-2
其他文章

订阅TargetMol新闻
科学新闻、观点和分析的重要汇总,每个工作日都会发送到您的收件箱.




 |
|