 您的购物车当前为空
您的购物车当前为空
Nature重磅 | 破解PARP抑制剂耐药背后的组蛋白周转机制,发现肿瘤治疗新靶点!

聚腺苷二磷酸核糖聚合酶1(PARP1 )是细胞中的主要 PARP 酶,调控多种生物学过程和细胞功能,包括 DNA 修复、复制、染色质结构和转录。在肿瘤治疗中,PARP抑制剂(PARPi)虽然能显著延长患者的无进展生存期(PFS),但总生存(OS)改善有限。这主要归因于同源重组缺陷(HRD)肿瘤(如BRCA1或BRCA2胚系突变)的基因组不稳定使其易于产生耐药。
获得性耐药一般通过三种主要机制发生:同源重组修复的恢复、药物靶点的改变以及复制叉稳定性的增强。然而,目前我们对 PARP 抑制剂(PARPi )暴露后对染色质稳态的直接影响仍不清楚。
近期,荷兰癌症研究所的一个研究团队在 Nature 期刊发表了题为 NASP modulates histone turnover to drive PARP inhibitor resistance 的研究论文,发现 PARP 抑制会诱导组蛋白从染色质中释放,以维持癌细胞的存活和复制。通过对这一现象的解析,他们发现了克服 PARPi 耐药的潜在治疗靶点。

PARP 抑制会诱导组蛋白释放
组蛋白作为 DNA 缠绕的核心结构蛋白,不仅为染色质提供物理支撑,还在转录、复制和 DNA 修复等关键过程中发挥调控作用。
在最新研究中,研究者利用 BRCA1 缺陷和 BRCA1/53BP1 双敲除(ΔBRCA1Δ53BP1)的 HAP1 细胞构建了 PARPi 耐药模型。发现 PARPi 奥拉帕尼 处理会导致核心组蛋白(H2A、H2B、H3、H4)在可溶性组分中显著积累,同时在染色质中减少,而这一现象在正常细胞中并未出现,提示其为 肿瘤细胞特有的 机制,并且与 BRCA1 状态无关。
进一步分析发现,这些可溶性组蛋白来源于染色质,而非新合成。组蛋白释放发生在 DNA 损伤信号(γH2AX)激活之后,表明 异常的组蛋白周转 可能是 PARPi 耐药的重要机制。
随后,研究者通过基因陷阱筛选鉴定了 PARPi 诱导组蛋白释放的关键调控因子。包括 DNA 修复因子 RNF168、HELQ,以及 H3-H4 组蛋白伴侣 DNAJC9 与 NASP。其中,DNAJC9 缺失会普遍削弱细胞存活,而 NASP 缺失 则主要在 PARPi 处理下显著降低细胞生存率。这表明 NASP 对组蛋白稳定性及 PARPi 应答至关重要。
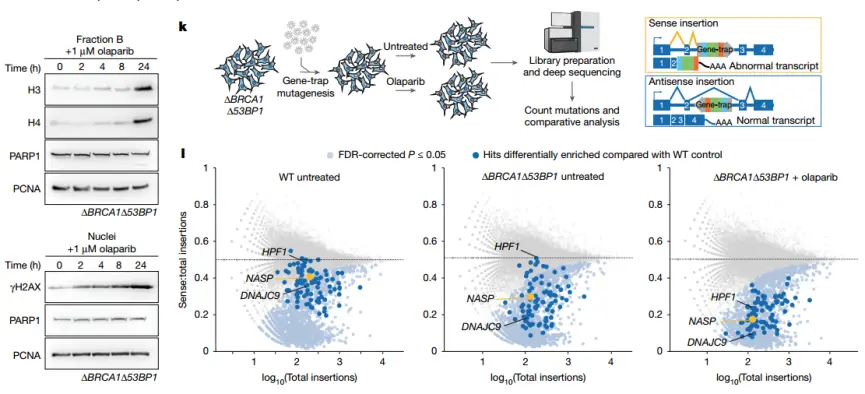
鉴定 PARPi 诱导染色质组蛋白释放所需的因子
NASP 缺失赋予细胞对 PARPi 的敏感性
由于 PARPi 会促使组蛋白从染色质中释放,而 NASP 的缺失会导致在 PARPi 处理后细胞存活率下降,研究接下来探究了 NASP 是否必需于 PARPi 处理后可溶性组蛋白的积累。
结果显示,NASP 是维持 PARPi 处理后组蛋白 H3-H4 稳定性的关键因子。缺失 NASP 时,PARPi 释放的 H3-H4 不能积累,而是被蛋白酶体降解,且蛋白酶体抑制剂 MG132 可阻断这一过程;外源性过表达 sNASP 则能恢复其水平。
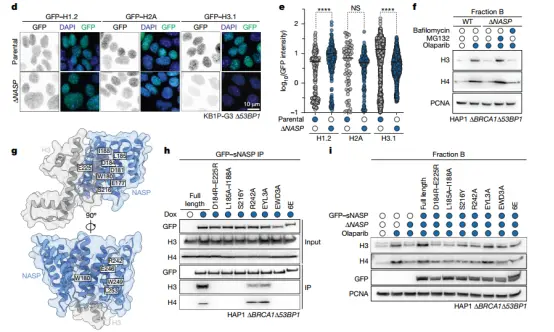
NASP 缺失通过蛋白酶体降解降低 PARPi 处理后可溶性组蛋白 H3 和 H4 的储备
当 NASP 被耗竭时,肿瘤细胞对 PARPi 的敏感性显著增强,无论在体外还是动物模型中均如此。其机制在于 NASP 缺失会削弱 DNA 复制叉的推进,导致复制相关的 DNA 损伤积累,加剧了癌细胞对 PARPi 的脆弱性。
具体表现为:
复制影响:NASP 急性降解使复制叉处染色质可及性升高,DNA 复制速度下降,EdU 掺入减少,DNA 轨迹缩短。
DNA 损伤与细胞周期:导致 S 期 γH2AX 增加,细胞在 G2/M 检查点停滞,并在 PARP 抑制剂处理后出现更多凋亡。
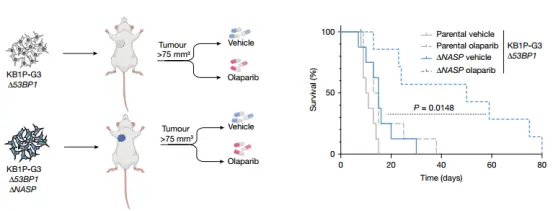
NASP的缺失导致体外和体内对PARP抑制剂的超敏反应
INO80 复合物和 PARP1 与 NASP 协同作用,以调控组蛋白周转
但值得注意的是,NASP 并非单独作用。NASP 与 INO80 染色质重塑复合物以及 PARP1(PARPi 的直接作用靶点)的伴侣活性协同,共同调控组蛋白周转。
INO80 染色质重塑复合体是组蛋白从染色质释放的关键介导者,其组分 UCHL5 的缺失会减少 PARPi 诱导的组蛋白释放并增强细胞对 PARPi 的敏感性。ASP、INO80 和 PARP1 的协同作用构建了一个复杂的组蛋白动态调控网络,使癌细胞能够在治疗引发的基因毒性压力下维持生存。
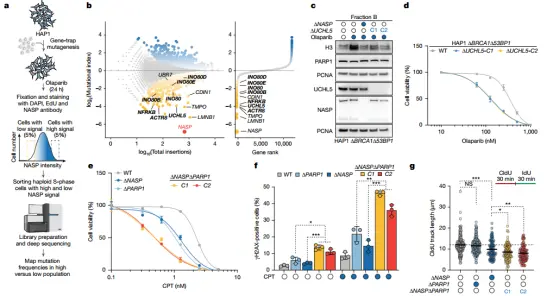
INO80 复合物和 PARP1 与 NASP 协同作用,以调控组蛋白周转
此外,NASP 不仅是 PARPi 的作用靶点,还通过自身的组蛋白伴侣活性与 NASP 协同作用,促进释放组蛋白的再整合,确保组蛋白周转效率。单独缺失 PARP1 会导致组蛋白 H3 的异常积累,NASP 缺失则使组蛋白无法稳定存在;两者双缺失则导致 DNA 损伤和复制障碍显著加剧,细胞凋亡增加,证实了二者协同在维持组蛋白稳态中的必要性。
小结
该研究显示,PARP 抑制会诱导组蛋白从染色质中释放,这暴露了 PARPi 耐药癌细胞的一个脆弱点:它们需要依赖组蛋白稳态机制以维持高 DNA 复制速率和存活。
通过功能性基因筛选,研究鉴定出 NASP 作为维持被驱逐组蛋白稳定性的关键因子,其作用依赖于 TPR 结构域。NASP 缺失使肿瘤细胞在体外和体内对 PARPi 高度敏感,同时削弱复制叉进程并增加复制相关 DNA 损伤水平。此外,NASP 与 INO80 复合体以及 PARP1 的伴侣活性协同作用,确保组蛋白高效周转并防止致命 DNA 损伤积累。
总体而言,该研究首次将组蛋白释放与周转调控纳入PARPi耐药机制的核心框架,并确定 NASP 是调控这一过程的核心因子。它不仅重塑了对 PARPi 毒性与耐药机制的理解,还为联合治疗提供了新的方向。未来,围绕 NASP、INO80 与 PARP1 相互作用的分子机制研究,以及开发干扰组蛋白伴侣功能的小分子药物,可能为攻克 PARPi 耐药开辟全新路径,加速精准肿瘤治疗的进展。
科研助力
TargetMol 为您提供PARP-1 靶向化合物库 ,该库结合了结构药理学筛选与分子对接的方法。我们基于 六个最佳分辨率的 PARP-1–抑制剂复合物晶体结构 构建超重叠模型,并通过该模型进行结构药理学筛选。筛选得到的高分化合物在对接时与人类 PARP-1 的晶体结构(PDB ID: 4PJT)中的配体高度重叠。最终化合物的挑选,则综合考虑了对接评分、分子间疏水接触,以及与关键活性位点残基的氢键相互作用。
如需了解更多详细信息,欢迎随时私信我们~

参考资料:
1. Mout et al., Design of soluble Notch agonists that drive T cell development and boost immunity, Cell (2025),https://doi.org/10.1016/j.cell.2025.07.009

其他文章

订阅TargetMol新闻
科学新闻、观点和分析的重要汇总,每个工作日都会发送到您的收件箱.




 |
|