购物车
 您的购物车当前为空
您的购物车当前为空

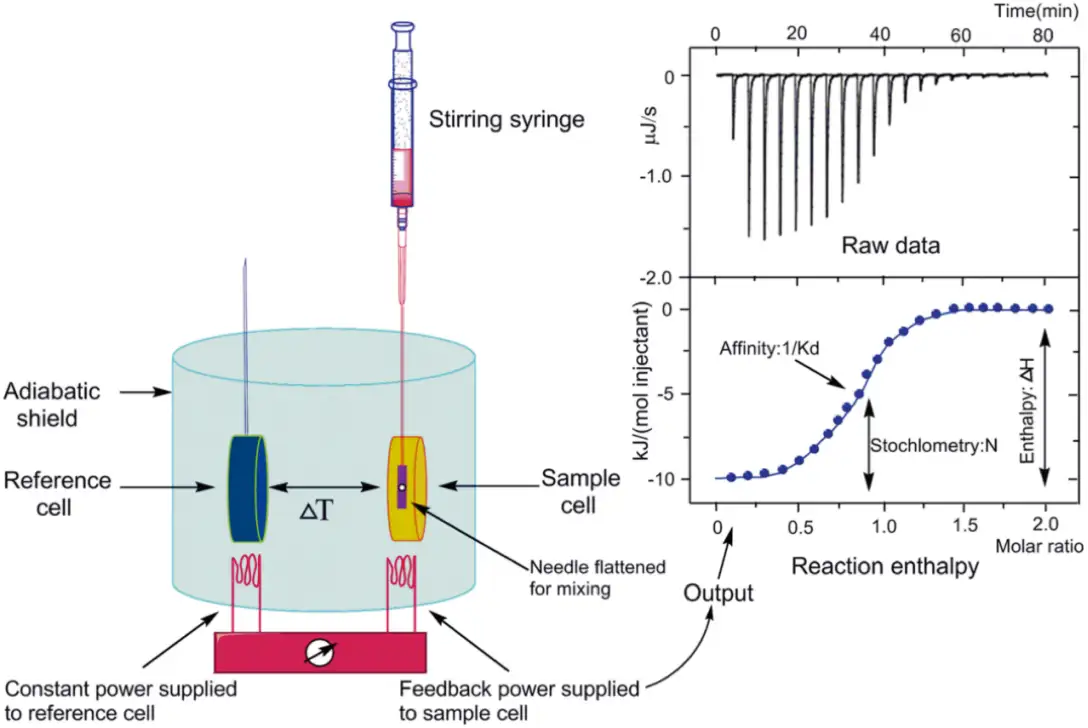
Kd/Ka/Kd分析。结合亲和力定量。


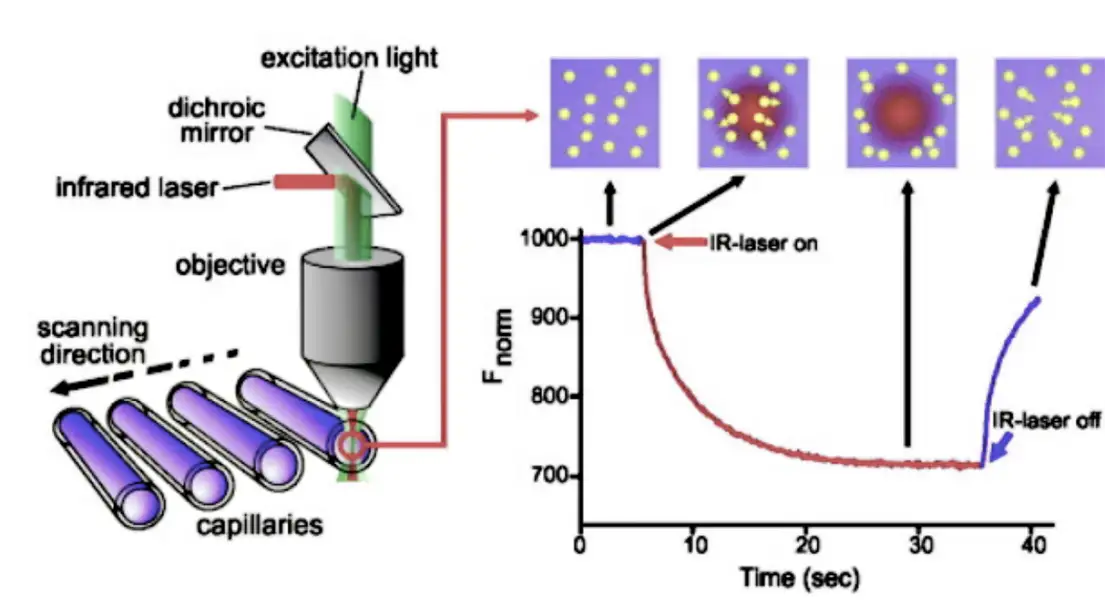
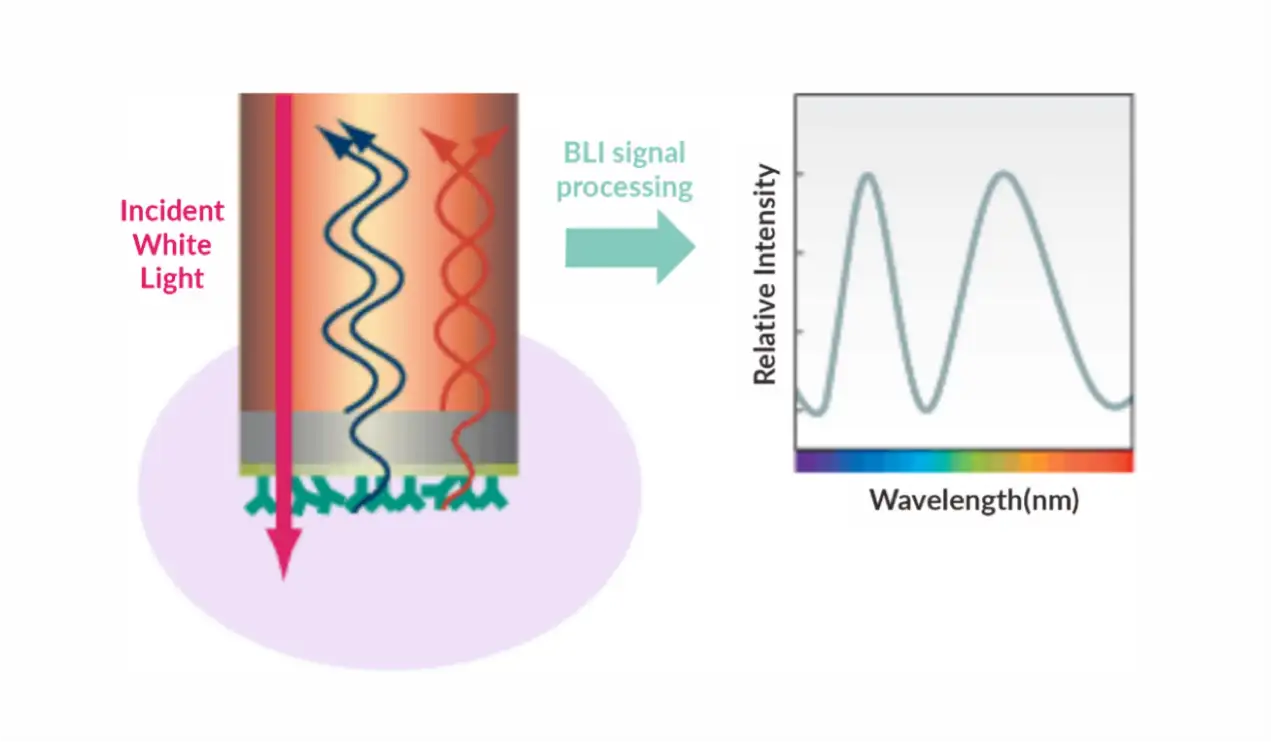
原理:表面等离子体共振(SPR)是一种由光子或电子引起的光学现象。 当光从光学致密介质入射到光学稀疏介质时,发生全内反射,形成进入光学稀疏介质的倏逝波。 引起表面等离子体共振的入射角被称为SPR角。 SPR现象与金属表面的折射率有关。 当分析物与芯片结合时,折射率会发生变化,从而导致SPR角度发生变化。 生物传感器实时检测这些变化,从而可以监测分子相互作用。 在实验中,一个生物分子固定在芯片表面,与之相互作用的分子溶解在流过芯片表面的溶液中。 该探测器实时跟踪分子结合和离解的变化。 基于Biacore的表面等离子体共振(SPR)可以高度灵敏地实时监测两种分子(包括蛋白质、分子、DNA、RNA)之间的相互作用,实现高通量筛选。 SPR实验作为一种创新的生物传感分析技术,涵盖了药物开发的各个阶段,包括靶点发现、药物筛选、蛋白质组学、免疫原性、生物制药研发、生产以及生命科学研究。