 您的购物车当前为空
您的购物车当前为空
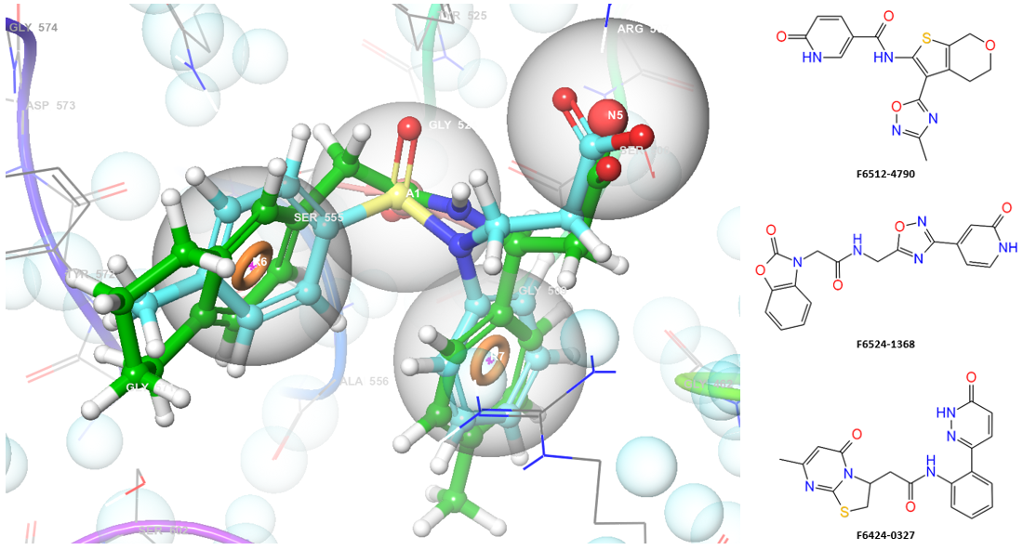
Keap1
KEAP1-NRF2 应激反应通路是细胞对抗氧化和亲电子应激的关键诱导性防御机制。转录因子Nrf2调控数百个基因的表达,其中包括参与细胞应激保护的细胞保护基因。在正常条件下,Keap1与Nrf2结合并引导其发生蛋白酶体降解。而在氧化应激状态下,Keap1-Nrf2相互作用被破坏,使Nrf2能够激活保护性基因转录。由于氧化应激会损害氧化还原信号传导并导致分子损伤,KEAP1-NRF2通路在衰老相关疾病、糖尿病、心血管疾病、癌症、神经退行性疾病(阿尔茨海默病、帕金森病和多发性硬化症)、中风、肝肾疾病及某些病毒性疾病的病理机制中发挥重要作用。因此,调控KEAP1-NRF2蛋白质相互作用对开发针对多种疾病的新型高效药物具有重要意义。
我们的KEAP1-NRF2靶向化合物库基于KEAP1蛋白-配体复合物的药效团模型构建,该模型采用已报道的新一代非共价抑制剂特征,可调控KEAP1-NRF2蛋白质相互作用。
核心特性
构建方法:基于药效团的虚拟筛选
采用X射线数据:8IVG
应用筛选条件:QikProp物性参数与描述符
入选化合物数量:659个
BCL‑2
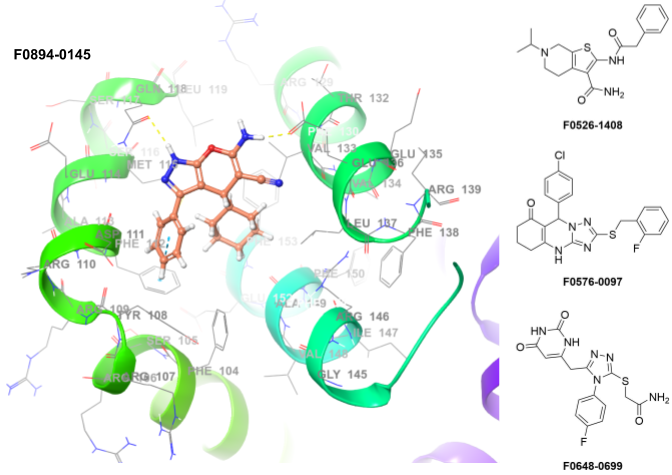
BCL-2蛋白家族通过调控线粒体外膜完整性在细胞死亡调节中起关键作用。BAK、BAX等促凋亡蛋白在细胞凋亡过程中具有核心功能,而当其被BCL-2、BCL-XL等抗凋亡蛋白结合后,促凋亡效应将被抑制。通过结合抗凋亡BCL-2蛋白家族来破坏该相互作用的小分子化合物,已被设计用于诱导癌细胞凋亡。
核心特性
构建方法:高通量虚拟筛选(分子对接)
采用X射线数据:6GL8
位置约束:是
氢键约束:ALA149、GLU136、GLN118、ASP111
允许蛋白可旋转基团:是
应用筛选条件:PAINS结构、毒性、反应性
入选化合物数量:372个
MDM2–p53
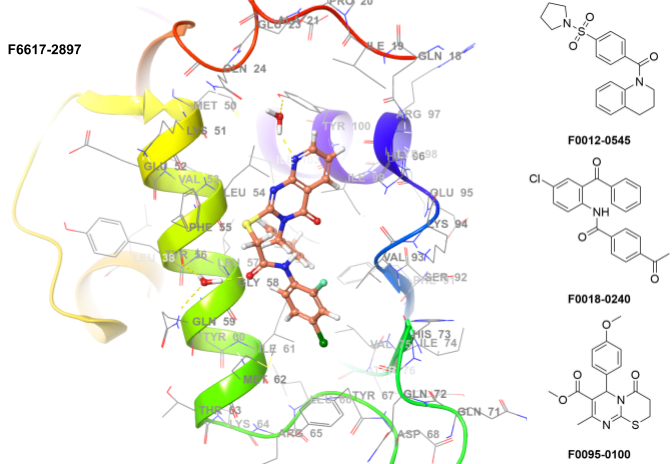
p53是一种有效的肿瘤抑制因子,因其可通过功能激活来根除肿瘤而成为极具吸引力的癌症治疗靶点。在约半数人类癌症中,编码p53蛋白的基因发生突变或缺失,导致其肿瘤抑制功能失活。而在保留野生型p53的癌症中,其功能被人源鼠双微体2(MDM2)癌蛋白通过直接相互作用有效抑制。因此,阻断MDM2-p53相互作用以重新激活p53功能,已成为一种前景广阔的癌症治疗策略。
核心特性
构建方法:高通量虚拟筛选(分子对接)
采用X射线数据:4ZYF
位置约束:是
氢键约束:HOH323、HOH302、VAL93、GLN72
允许蛋白可旋转基团:是
应用筛选条件:PAINS结构、毒性、反应性
入选化合物数量:1,679个
LFA1–ICAM1
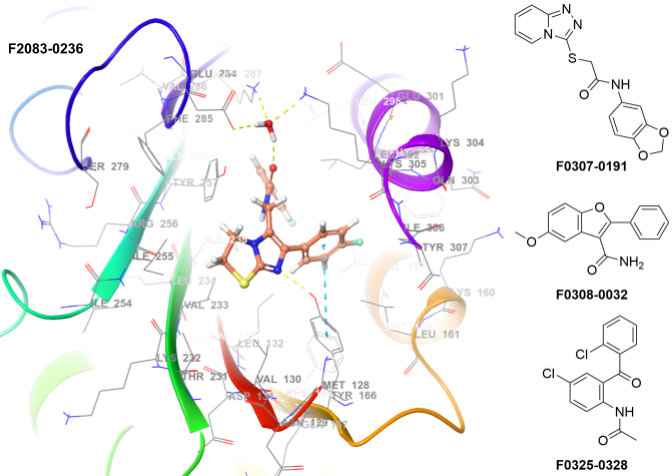
淋巴细胞功能相关抗原-1(LFA-1)虽是人类众多整合素之一,但其特异性表达于白细胞的特征赋予其特殊生物学意义。研究表明,LFA-1及其主要配体ICAM-1通过淋巴细胞和髓系细胞对肿瘤细胞的作用,与癌症发生发展密切相关。LFA-1不仅介导白细胞与肿瘤的相互作用,ICAM-1在肿瘤动态进展中更可独立于LFA-1发挥关键功能。
核心特性
构建方法:高通量虚拟筛选(分子对接)
采用X射线数据:3M6F、2ICA
位置约束:未应用
氢键约束:HOH408、HOH324
允许蛋白可旋转基团:是
应用筛选条件:PAINS结构、毒性基团、反应性基团
入选化合物数量:1,779个
αIIbβ3
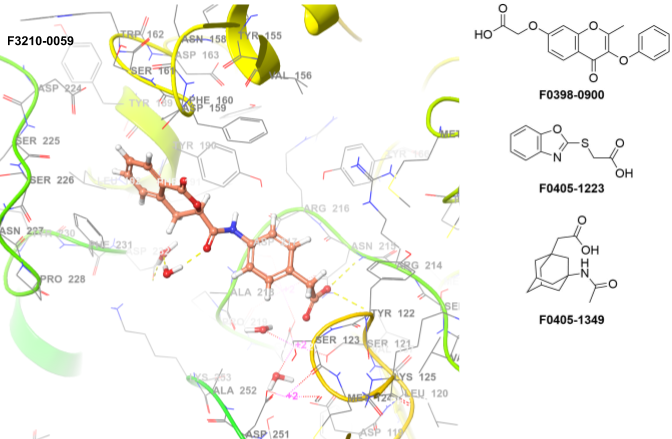
血小板上的整合素αIIbβ3在止血和血栓形成的早期阶段被激活,并与配体纤维蛋白原结合。该整合素特异性结合于二聚体纤维蛋白原分子的远端,即γ亚基C末端的天然非结构化区域(γC肽)。纤维蛋白原上两个αIIbβ3结合位点之间约440 Å的巨大间距非常适合血小板交联,从而导致血小板聚集并在止血和血栓形成过程中形成血小板栓。在止血过程的后续阶段,纤维蛋白原α和β亚基N末端肽段的切割会刺激纤维蛋白原组装成纤维蛋白。随后,纤维蛋白中相邻的纤维蛋白原分子通过因子XIIIa转谷氨酰胺酶作用,经由γC肽发生交联。由于γC肽在止血和血栓形成中的生物学及临床重要性,确定其生物学相关的整合素结合构象一直备受关注。目前临床使用的两种药物——小分子替罗非班和环肽依替巴肽,可通过与αIIbβ3形成复合物来预防血栓形成,其复合物结构已被解析。
关键特征
• 方法:高通量虚拟筛选(分子对接)
• 使用的X射线数据:2VDM
• 位置约束:无
• 氢键约束:TYR122、SER123、ASN215、ASN215、HOH4069、SER225、ASP224
• 金属配位:是
• 允许蛋白质旋转基团:是
• 使用的筛选规则:PAINS、毒性、反应性
• 筛选化合物数量:1,431个
IAP
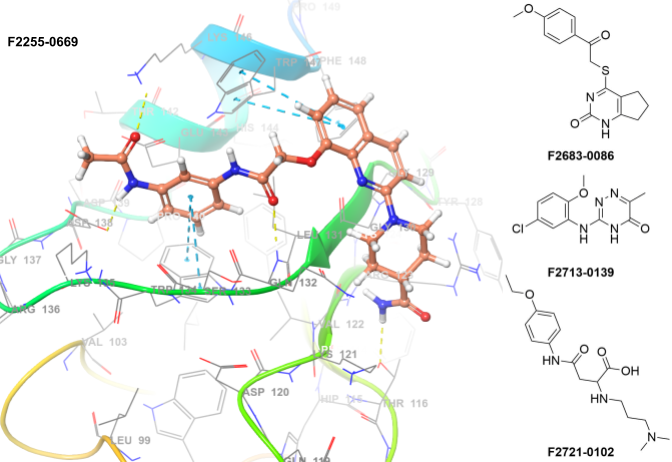
哺乳动物细胞凋亡抑制蛋白(IAP)家族成员,包括X染色体连锁IAP(XIAP)、细胞IAP1(cIAP1)、细胞IAP2(cIAP2)和黑色素瘤IAP(ML-IAP),在癌细胞中常过度表达,通过抵抗多种促凋亡刺激发挥保护作用。研究还表明IAP蛋白参与调控恶性肿瘤相关的信号转导通路。针对IAP的靶向策略主要聚焦于设计小分子化合物,模拟内源性IAP拮抗剂Smac/DIABLO(低等电点的第二线粒体源半胱天冬酶激活剂/直接IAP结合蛋白)与特定IAP蛋白BIR结构域表面浅沟的结合。
关键特征
• 方法:高通量虚拟筛选(分子对接)
• 使用的X射线数据:3UW5
• 位置约束:无
• 氢键约束:ASP138、GLN132、GLN132、TRP147
• 蛋白可旋转基团允许:是
• 使用筛选规则:PAINS规则、毒性规则、反应性规则
• 选定化合物数量:660
BET Bromodomain
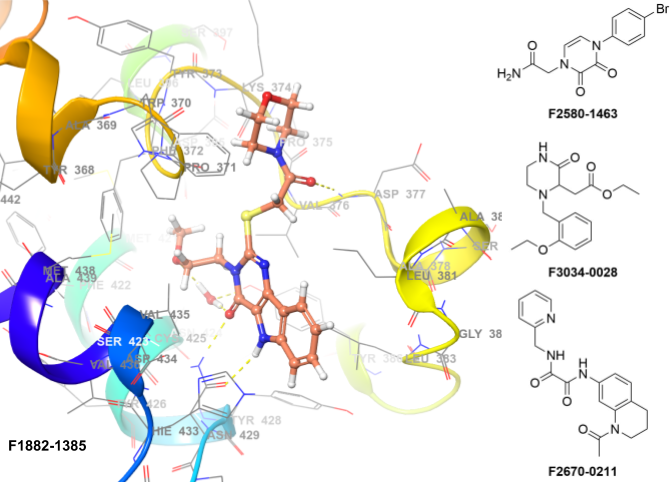
溴结构域和超末端结构域(BET)蛋白是一类表观遗传阅读器,包括广泛表达的BRD2、BRD3、BRD4以及BRDT。BET蛋白还能识别乙酰化的非组蛋白,包括多种转录因子。此外,BET蛋白还具有激酶活性,这一功能尚未被完全阐明。临床前研究的多项证据表明BET蛋白在人类癌症中发挥作用,这为靶向BET蛋白作为新型抗癌药物开发策略提供了理论依据。针对不同肿瘤类型的基因筛选研究反复证实,编码BET蛋白的基因是肿瘤细胞生存所依赖的关键基因。
核心特性
• 方法:高通量虚拟筛选(分子对接)
• 使用的X射线数据:4J1P
• 位置约束:无
• 氢键约束:HOH604、ASN429
• 蛋白可旋转基团允许:是
• 应用筛选规则:PAINS规则、毒性规则、反应性规则
• 筛选化合物数量:1,573个
BRD9
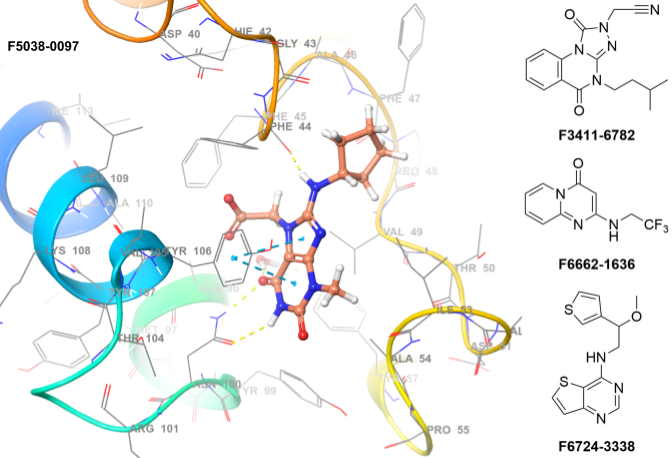
溴结构域(BRDs)是一类能够特异性识别ε-N-赖氨酸乙酰化基序的蛋白质相互作用模块,该识别过程是解读构成表观遗传密码的翻译后修饰的关键环节。含溴结构域蛋白7(BRD7)在癌症中常表达下调,其通过调控p53和PI3K通路被认为具有肿瘤抑制功能。此外,BRD7被证实是BRCA1依赖性转录的必要条件,其多态性也与胰腺癌风险增加相关。相比之下,BRD9因5号染色体短臂(5p)增益(宫颈癌中最常见的核型变化)而在癌症中频繁过表达。结构相近的BRD7与BRD9同属SWI/SNF核小体重塑复合物组分,该复合物在调控炎症基因等基因表达程序中起关键作用。鉴于BRD7/9在染色质中介导的相互作用复杂性,开发针对这些溴结构域的高选择性强效抑制剂具有重要价值:既可成为研究这类关键染色质相互作用域的功能研究工具,也有潜力用于多种疾病的小分子疗法开发。
核心特征
• 方法:高通量虚拟筛选(分子对接)
• 所用X射线数据:5EU1
• 位置约束:无
• 氢键约束:HOH301、ASN100
• 蛋白可旋转基团允许:是
• 应用筛选规则:PAINS规则、毒性基团、反应性基团
• 筛选化合物数量:1,562个





 很棒
很棒

 |
|