购物车
 您的购物车当前为空
您的购物车当前为空
TMA-DPH 是疏水性荧光膜探针 (Ex=355 nm; Em=430 nm)。
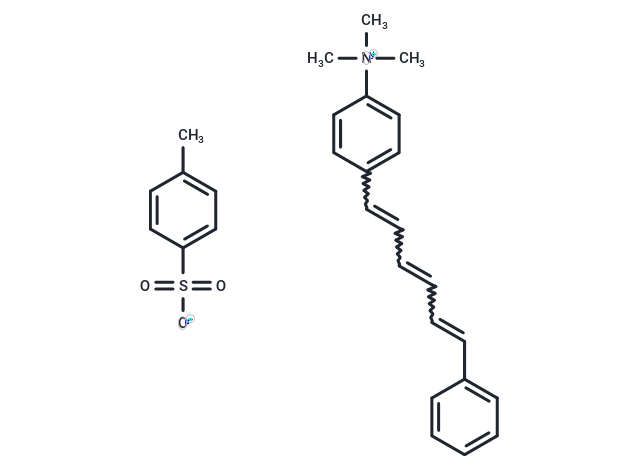
TMA-DPH 是疏水性荧光膜探针 (Ex=355 nm; Em=430 nm)。
| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 1 mg | ¥ 675 | 现货 |
| 产品描述 | TMA-DPH is a hydrophobic fluorescent membrane probe (Ex: 355 nm; Em: 430 nm). |
| 体外活性 | TMA-DPH荧光寿命在低于2μM的同一临界浓度下保持恒定值6.2±0.2 ns,但在更高浓度时显著降低;然而,该降低速度在5μM以上会放缓。TMA-DPH荧光各向异性的变化趋势与荧光寿命相似,起初在2μM以下保持恒定值0.283±0.003,随后在5μM时迅速降至0.270±0.003,并在更高浓度下继续以较慢速度下降[2]。 |
| 细胞实验 | 一、 荧光极化法测定细胞膜流动性 1. 溶液准备:将 TMA-DPH 溶解于适当的溶剂(如 DMSO),配制成 10-20 μM 的浓度。可根据实验需要优化浓度。 2. 细胞处理:将 TMA-DPH 溶液加入到培养的细胞中,通常用 0.1-2 μM 的浓度处理细胞。处理时间为 15-30 分钟,确保探针能够均匀地嵌入细胞膜。 3. 荧光测量: 1)使用荧光偏振(荧光极化)设备,激发波长设置为 355 nm,发射波长为 430 nm,测量荧光极化值。 2)记录不同时间点或不同条件下的荧光极化值,以分析细胞膜的流动性变化。 4. 数据分析: 根据荧光极化值的变化,分析细胞膜的流动性。较高的极化值表示细胞膜较为固态(较低的流动性),而较低的极化值则表示膜具有较高的流动性。 二、膜区域流动性分析: 1. 膜区域的选择:对不同膜区域(如质膜、内质网膜等)进行特定标记或分选,可以采用单层膜或双层膜作为研究对象。 2.实验设计:向细胞培养液中加入 TMA-DPH,并通过适当的技术(如共聚焦显微镜、荧光显微镜)检测特定区域的荧光极化。 3. 分析数据:比较不同膜区域的荧光极化数值,可以研究不同膜区域的流动性差异。 以上信息均来源于已发表文献,具体实验方案请根据实际研究需求进行适当调整。 |
| 分子量 | 461.62 |
| 分子式 | C28H31NO3S |
| CAS No. | 115534-33-3 |
| Smiles | Cc1ccc(cc1)S([O-])(=O)=O.C[N+](C)(C)c1ccc(C=CC=CC=Cc2ccccc2)cc1 |
| 密度 | no data available |
| 存储 | keep away from direct sunlight | In solvent: -80°C for 1 year | Shipping with blue ice/Shipping at ambient temperature. | |||||||||||||||||||||||||||||||||||
| 溶解度信息 | DMSO: 55 mg/mL (119.15 mM), Sonication is recommended. | |||||||||||||||||||||||||||||||||||
| 体内实验配方 | 10% DMSO+40% PEG300+5% Tween-80+45% Saline: 1.67 mg/mL (3.62 mM), Sonication is recommended. 请按顺序添加溶剂,在添加下一种溶剂之前,尽可能使溶液澄清。如有必要,可通过加热、超声、涡旋处理进行溶解。工作液建议现配现用。以上配方仅供参考,体内配方并不是绝对的,请根据不同情况进行调整。 | |||||||||||||||||||||||||||||||||||
溶液配制表 | ||||||||||||||||||||||||||||||||||||
DMSO
| ||||||||||||||||||||||||||||||||||||
对于不同动物的给药剂量换算,您也可以参考 更多