 您的购物车当前为空
您的购物车当前为空
获FDA批准的组蛋白去乙酰化酶(HDAC)抑制剂有哪些?

基因表达的调控通过多种机制介导,如 DNA 甲基化、依赖 ATP 的染色质重塑以及组蛋白的翻译后修饰。后一种机制包括对核心组蛋白尾部中赖氨酸残基ε-氨基基团的乙酰化和去乙酰化动态调控。
组蛋白是染色质的主要蛋白成分,稳定核小体核心结构(核小体是染色质的基本单位,由DNA和蛋白质组成),同时也会经历多种特定的翻译后修饰。核小体组蛋白的可逆乙酰化和去乙酰化在染色质结构的调控、染色质功能以及基因表达的调节中起着关键作用。负责这种可逆乙酰化/去乙酰化过程的酶分别是 组蛋白乙酰转移酶(HATs)和 组蛋白去乙酰化酶(HDACs)。
HDAC分类
在人类中,已发现18种HDAC,这些酶根据其催化机制可分为两大类:
11种HDAC为锌依赖型金属酶(HDAC1−11),通过以水分子作为亲核试剂水解酰胺键;
7种脱乙酰化酶为Sirtuins(Sirt1−7),利用NAD+作为辅因子,将酰基转移至核糖糖环的C2位。
尽管两类酶都能完成赖氨酸乙酰化的化学裂解反应,但“HDAC”一词通常指锌依赖型酶。
人类组蛋白脱乙酰酶(HDACs)根据其序列同源性和细胞定位可进一步分为四类:
I类:HDAC1、HDAC2、HDAC3、HDAC8
IIa类:HDAC4、HDAC5、HDAC7、HDAC9
IIb类:HDAC6、HDAC10
III类:Sirtuins 1−7
IV类:HDAC11
其中,核心是HDAC1、HDAC2和HDAC3,这些同种型在细胞核中以多蛋白复合物的形式存在,负责去乙酰化组蛋白和转录调节因子,并且在生命形式中普遍存在。接下来是HDAC6,负责细胞质蛋白的去乙酰化。随后是催化活性较差的HDAC4、HDAC5、HDAC7和HDAC9。HDAC8和HDAC11则优先水解非乙酰酰基赖氨酸底物,HDAC10则是一种多胺去乙酰化酶。
HDAC催化机制
乙酰赖氨酸底物位于一个由疏水残基围绕的狭窄通道中,其中酪氨酸残基通过构象翻转与羰基氧形成氢键(图A)。通道的疏水特性以及酪氨酸残基的构象变化赋予了酶对乙酰赖氨酸侧链的特异性。通道末端存在一个由天冬氨酸和组氨酸残基配位的锌离子,与一个通过电荷中继机制被激活的水分子结合。水分子对羰基的亲核攻击生成四面体氧阴离子中间体(图B),随后该中间体坍缩,生成游离赖氨酸和乙酸产物(图C)。
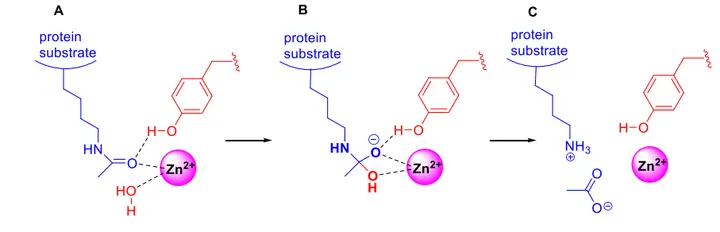
HDAC催化去乙酰化机制的简化示意图:
(A) 酶-底物复合物,展示了带有乙酰赖氨酸的蛋白底物与酶活性位点中的酪氨酸残基及锌离子之间的结合相互作用;
(B) 由于水分子的亲核攻击形成的四面体氧阴离子酶中间体;
(C) 酶-产物复合物,其中赖氨酸残基和乙酸在从活性位点释放前结合于酶中。
HDAC抑制剂开发
HDAC在各种实体瘤中过表达或过度活跃,并抑制肿瘤抑制基因的表达,从而导致增殖不受控制以及对细胞修复机制和细胞凋亡不敏感。因此,HDAC也是开发特异性抗癌药物的潜在靶点。
大多数HDAC抑制剂具有三种主要药效团:Cap基团(表面识别基团)、ZBG(锌结合基团)以及连接 Cap 基团和 ZBG 的Linker,其结构如下图所示。
根据结构类型,HDAC抑制剂可分为四类:羟肟酸类、环四肽类、苯甲酰胺类和脂肪酸类。
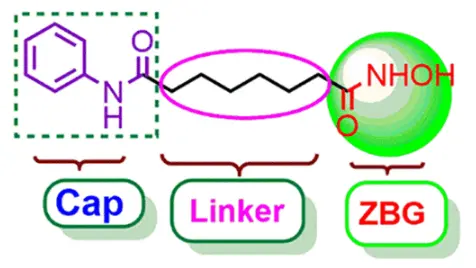
HDAC 抑制剂结构功能示意图
目前已知FDA批准的HDAC抑制剂包括SAHA(Vorinostat) 、Panobinostat 、Chidamide(西达本胺) 、Belinostat 和 Romidepsin 。
HDAC抑制剂具有灵活的结构,易于与其他抗肿瘤药物结合,例如拓扑异构酶(Top)抑制剂和受体酪氨酸激酶(RTK)抑制剂,包括血管内皮生长因子受体(VEGFR)、表皮生长因子受体(EGFR)、EZH2(Enhancer of Zeste Homolog 2)及c-Met抑制剂。
将HDAC抑制剂与这些抗肿瘤药物联合使用可对癌细胞的生命过程产生协同作用。因此,双功能单分子(双靶点药物)成为癌症治疗中的一种极具前景的策略,同时也是解决单靶点药物毒性过高,耐受性等问题的合理方法。
在这,TargetMol 可为您提供两种基于受体的HDAC 靶向文库 ,专门针对I 类和II 类HDAC 亚型,以充分程度减少这两个类之间的交叉反应。
(1) 专注HDAC I 类库 - 599个化合物;
(2) 专注HDAC II 类库 - 204个化合物。

参考资料:
[1] Biersack B, Polat S, Höpfner M. Anticancer properties of chimeric HDAC and kinase inhibitors. Semin Cancer Biol. 2022;83:472-486. doi:10.1016/j.semcancer.2020.11.005
[2] Roy R, Ria T, RoyMahaPatra D, Sk UH. Single Inhibitors versus Dual Inhibitors: Role of HDAC in Cancer. ACS Omega. 2023;8(19):16532-16544. Published 2023 May 1. doi:10.1021/acsomega.3c00222
[3] Ho TCS, Chan AHY, Ganesan A. Thirty Years of HDAC Inhibitors: 2020 Insight and Hindsight. J Med Chem. 2020;63(21):12460-12484. doi:10.1021/acs.jmedchem.0c00830
其他文章

订阅TargetMol新闻
科学新闻、观点和分析的重要汇总,每个工作日都会发送到您的收件箱.




 |
|