 您的购物车当前为空
您的购物车当前为空

- 具有直观的搜索结果
- 更便捷高效地比较产品细节
- 快速、简洁的提交订单
- 成为我们TargetMol的一员,阅读和提交您的产品建议和意见
我们很想知道您的意见反馈,所以我们在每个页面上都梳理出一个反馈按钮。
截至 2023 年,美国食品药品监督管理局(FDA)药物评估与研究中心(CDER)在该年度批准了 55 款新药。近十年来,CDER 每年批准的药物数量平均也持续攀升,目前已达到每年 46 个。下面是历年批准药物数据的对比:
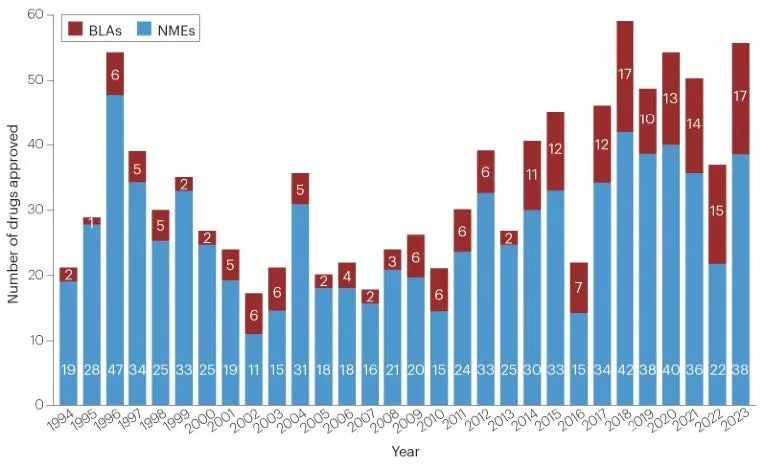
近30年FDA批准新药。新分子实体(蓝)生物制品(红)
按疾病领域来划分,肿瘤依旧是创新药物大热领域,2023 年 CDER 批准了 13 种新的抗癌疗法。神经学次之,有 9 种(16%)药物获批。感染性疾病和血液疾病并列第三,各有 5 种(9%)获批。其中有着不少重磅疗法获批上市,快和小陶一睹为快吧~。
文末还有 55 款新药信息归纳表,记得点击保存噢~
部分突破性疗法
lecanemab:阿尔茨海默病新药

Lecanemab 是 20 年来首款 FDA 完全批准的 AD 新药,对 Aβ 原纤维具有高选择性,在临床试验中,与安慰剂相比,可显著减少了 Aβ 斑块并防止 Aβ 在大脑中的沉积。2023 年 1 月 6 日,Lecanemab 获得了 FDA 对阿尔茨海默病治疗的加速批准。在 2023 年 7 月 6 日,它获得了 FDA 的全面批准。
Omaveloxolone:首款Friedreich共济失调药物
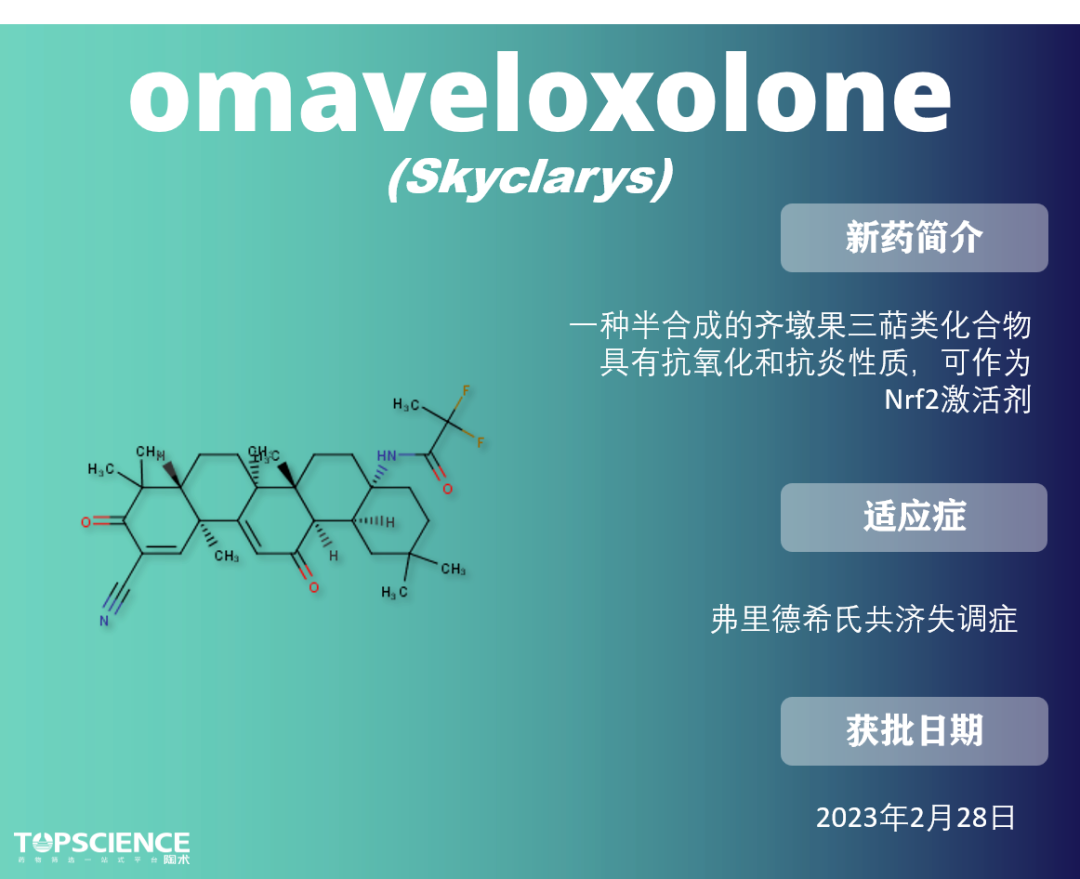
弗里德里希共济失调症是一种逐渐损害神经系统的罕见遗传性疾病,其特点是 Nrf2 途径受损,Nrf2 活性较低。
Omaveloxolone 作用机制尚未完全阐明,但它 作为核因子 2 样转录因子(Nrf2)的激活剂,起到缓解氧化应激的作用。因此,使用 Nrf2 激活剂,如 Omaveloxolone,在这类患者中具有治疗优势。
Tofersen:首款SOD1 突变的ALS药物

Tofersen 在 28 周内可显著降低脑脊液中 SOD1 和血浆中神经纤维丝轻链(NFL)的浓度。于 2023年4月25日获得 FDA 的加速批准,成为 首个用于治疗由 SOD1 突变引起的成人 ALS 患者的药物。
Talquetamab:首款GPRC5D/CD3双抗

Talquetamab 由两个部分组成——抗 GPRC5D 和抗 CD3 部分,通过两个链间二硫键相连,每个部分包括一个重链和一个轻链。Talquetamab 结合到 GPRC5D,这是主要表达在多发性骨髓瘤细胞表面的细胞表面受体,以及 T 细胞上的 CD3。它的作用是 招募表达 CD3 的 T 细胞到表达 GPRC5D 的多发性骨髓瘤细胞,诱导 T 细胞介导的细胞毒性。
2023 年 8 月 9 日,talquetamab 获得了 FDA 的加速批准,2023 年 8 月 22 日,欧洲药品管理局(EMA)批准其上市。
Capivasertib:首款AKT抑制剂
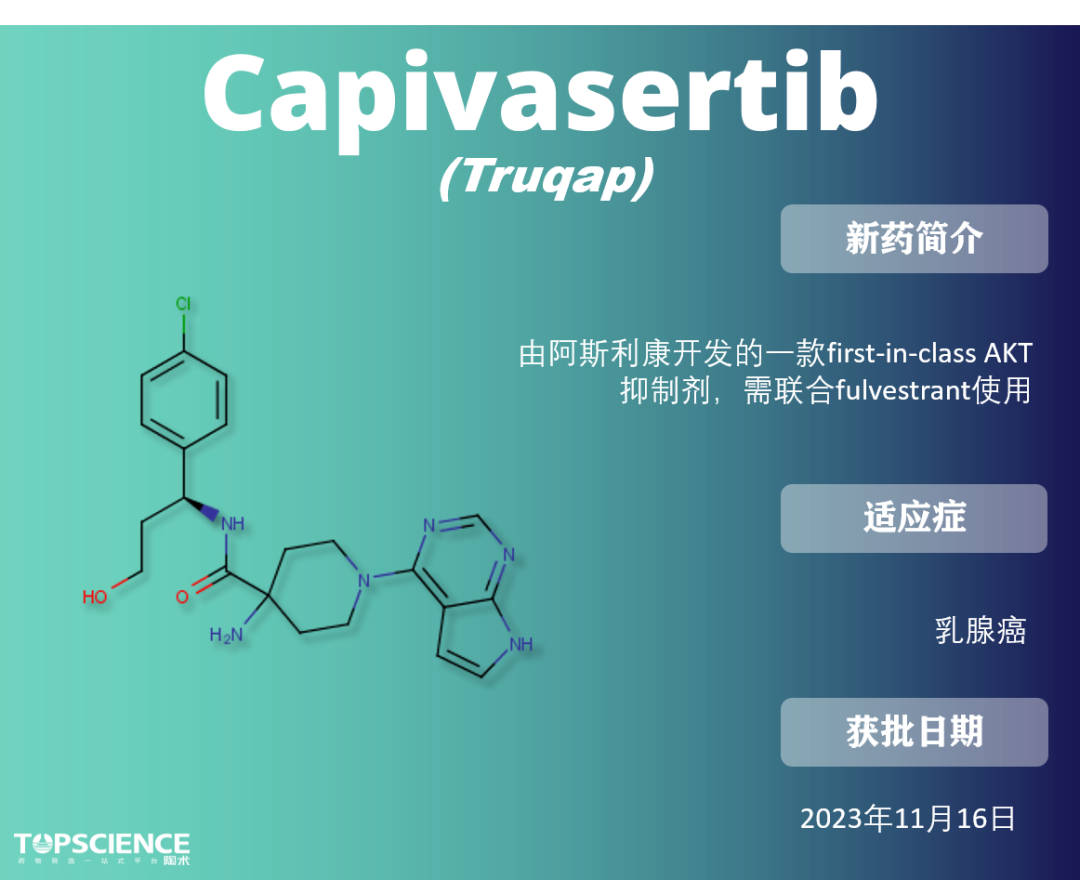
激素受体(HR)阳性,尤其是雌激素受体阳性、HER2 阴性的乳腺癌是转移性乳腺癌最常见的亚型之一,每年导致 400,000 人死亡。尽管内分泌为基础的治疗是第一线治疗,但最终会出现耐药性,使化疗成为唯一但通常无效的治疗选择。因此,大量研究致力于开发基因靶向治疗。
PI3K/AKT 途径是乳腺癌中最常激活的途径之一,主要通过 AKT1 的活性突变、PI3K/AKT 途径的负调控因子 PTEN 的功能丧失突变,或 PI3KCA 的突变来实现。因此,靶向 PI3K/AKT 途径为乳腺癌治疗提供了有希望的方法,由此开发出了 capivasertib。
Nirogacestat:首款硬纤维瘤药物

硬纤维瘤通常以 Notch 信号异常激活为特征。Notch 受体与其配体之间的相互作用通过 γ-分泌酶的蛋白酶切割而激活;因此,抑制 γ-分泌酶可能潜在地抑制 Notch 信号传导,从而阻碍硬纤维瘤的生长。
Nirogacestat 是一种小分子 γ-分泌酶抑制剂,此前,它已被授予硬纤维瘤的突破性疗法、快速通道和孤儿药物资格,最终基于 3 期 DeFi 试验的积极结果获 FDA 批准上市,该试验显示 疾病客观缓解率为 41%,而安慰剂组仅有 8%。
罕见病FIC疗法
Daprodustat:首个肾脏病患者贫血口服药
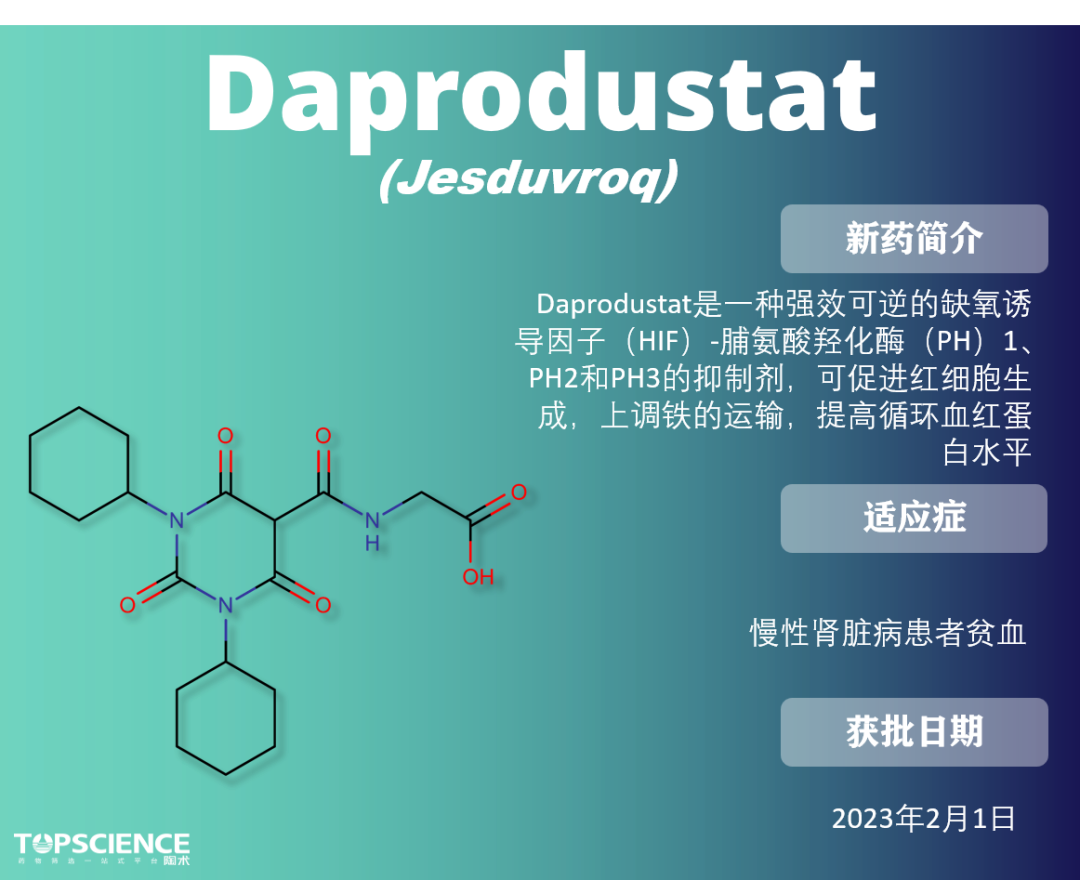
患有慢性肾脏病(CKD)的患者无法在缺氧或贫血的情况下诱导促红细胞生成素(EPO)的产生。作为 PHD1、PHD2 和 PHD3 的强效抑制剂,daprodustat 稳定细胞中的 HIF1α 和 HIF2α,诱导促红细胞生成。
2020 年 6 月,daprodustat 首次在日本获得治疗肾性贫血的批准。2022 年 10 月,FDA 心血管和肾脏药物咨询委员会(CRDAC)支持 daprodustat 治疗 CKD 贫血的益处大于风险,适用于进行透析的成年患者,但不适用于非透析的 CKD 患者。2023 年 2 月 1 日,FDA 全面批准了 daprodustat,成为 慢性肾脏病透析患者贫血的首个口服治疗药物。目前,该药物正在接受 EMA 审查。
Fezolinetant:首款VMS非激素治疗药物
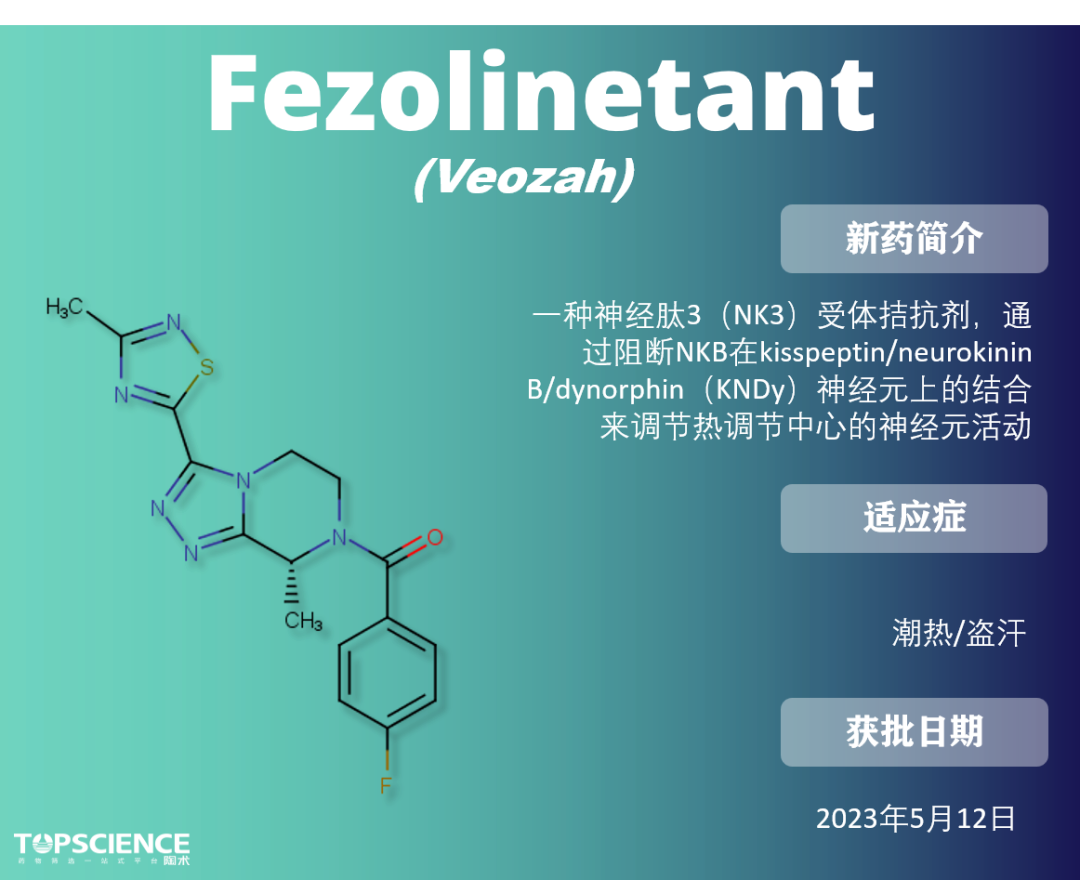
潮热症状的病理生理学尚未完全揭示,但雌激素水平的波动被认为是潮热症状的主要原因,雌激素疗法也是最有效的潮热症状治疗方法。
NK3 是 KNDy 神经元中表达的受体之一,受神经肽 B 激活,从而诱导 GnRH 的释放。绝经期雌激素水平降低将减少雌激素介导的反馈循环,并增加神经肽 B 信号传导,增加 KNDy 神经元的活动,从而增加温度控制中心的活动。Fezolinetant 通过拮抗 NK3 受体,可以减缓神经信号传导以减轻潮热症状。
Zuranolone:唯一的产后抑郁症疗法
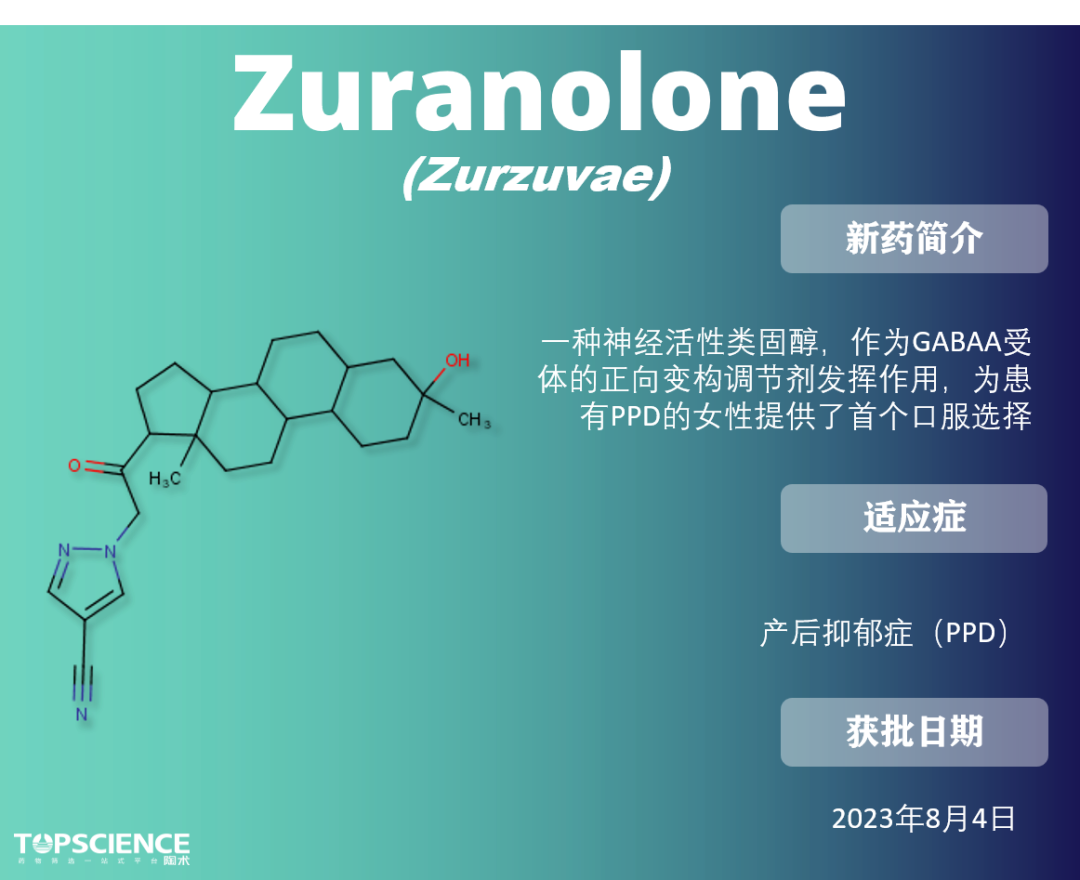
与市场上其他更常见的如苯二氮卓类药物等 GABAA 正向变构调节剂不同,由于结合到受体上的非苯二氮卓位点,zuranolone 对突触和突触外 GABAA 受体都起作用。目前是唯一获批用于治疗产后抑郁症的药物。
CBER批准的首创疗法
除开 CDER 批准的 55 款新药外,获 CBER 批准疗法也创下新纪录。CBER批准了14款生物制品,其中包含 5 款疫苗、5 款基因疗法、2 款细胞疗法,以及首款口服粪便微生物群疗法。
● Exagamglogene Autotemcel(Exa-cel; Casgevy)
Exagamglogene autotemcel 是一种自体 CRISPR-Cas9 修改的 CD34+人类造血干细胞和祖细胞,已在治疗严重 SCD 和重型 β-地中海贫血的临床试验中进行了研究。在移植后,它会增加 HbF 的产生,随后减少 HbS 的产生。是 首个基于 CRISPR 的基因编辑疗法,其一次性治疗定价为 220 万美元。
● Beremagene Geperpavec(Vyjuvek)
Beremagene geperpavec 是 首个获批用于治疗与营养不良型大疱性表皮松解症 (DEB)伤口的疗法。DEB 是由编码胶原 VII(COL7)的 COL7A1 基因突变引起的,COL7 是皮肤-表皮内聚的主要锚定纤维的组成部分。Beremagene geperpavec 经基因修改,能够传递 COL7A1,从而恢复 COL7 蛋白的水平,加速创伤修复。
● Donislecel(Lantidra)
CellTrans 的 Donislecel(Lantidra)由供体来源的胰岛细胞组成,成为 首个获得 FDA 批准的细胞疗法,用于无法达到目标 HbA1c 水平的 1 型糖尿病患者。在胰岛细胞输注后,患者需要终身免疫抑制以保持细胞的活性。
此外,FDA 还批准了 Seres Therapeutics 和 Nestlé 的 Vowst,用于预防抗生素后艰难梭菌感染。Vowst 是 首个药品级口服粪菌微生态制剂,与 Ferring/Rebiotix 的直肠给药微生态制剂 Rebyota 竞争,后者于 2022 年获得 FDA 批准。
小结
FDA批准的创新药物是全球药物研发的重要指标。在2023年,CDER 创新药物占比再次创下新高,CBER 批准的首创基因疗法也取得了令人瞩目的进展。这不仅为药物研发和医疗行业带来了新的里程碑,也为患者带来了巨大的希望。展望2024年,我们期待看到更多创新疗法获得批准,为患者带来福音。
目前陶术生物可提供上市药物 2,863 种,其中 1,729 种已被 FDA 批准,上文提到的 55 种药物多数陶术也能提供,欢迎大家咨询采购~

数据来源
[1] Mullard A. 2023 FDA approvals. Nat Rev Drug Discov.doi: https://doi.org/10.1038/d41573-024-00001-x
[2] https://www.fda.gov/drugs/new-drugs-fda-cders-new-molecular-entities-and-new-therapeutic-biological-products/novel-drug-approvals-2023
[3] https://go.drugbank.com/
[4] Mullard A. FDA approves first-in-class AKT inhibitor. Nat Rev Drug Discov. 2024;23(1):9. doi:10.1038/d41573-023-00202-w
[5] Kingwell K. γ-secretase inhibitor notches first approval. Nat Rev Drug Discov. 2024;23(1):9. doi:10.1038/d41573-023-00204-8
[6] Mullard A. FDA approves first Friedreich's ataxia drug. Nat Rev Drug Discov. 2023;22(4):258. doi:10.1038/d41573-023-00041-9
[7] PubChem (nih.gov)
其他文章

订阅TargetMol新闻
科学新闻、观点和分析的重要汇总,每个工作日都会发送到您的收件箱.

 嗨!有任何问题?点我咨询
嗨!有任何问题?点我咨询

版权所有©2015-2025 TargetMol Chemicals Inc.保留所有权利.
沪ICP备20019793号-4 | 沪公网安备 31010602006700号 | 沪(静)应急管危经许[2024]203441
| 沪(静)应急管危经许[2024]203441
