 您的购物车当前为空
您的购物车当前为空

- 具有直观的搜索结果
- 更便捷高效地比较产品细节
- 快速、简洁的提交订单
- 成为我们TargetMol的一员,阅读和提交您的产品建议和意见
我们很想知道您的意见反馈,所以我们在每个页面上都梳理出一个反馈按钮。
Nature重磅 | 诱导癌细胞凋亡新技术,或对多数癌症有效!
癌细胞获得基因突变后,会对数千个基因的表达进行重新编程,从而促进细胞快速生长,并阻断正常的细胞凋亡途径。尽管细胞凋亡被阻碍,但该通路本身并未消失。那么,如果我们能重新打开癌细胞凋亡通路的开关,是不是就可以借此对抗癌症呢?
以这个疑问为出发点,斯坦福大学的科学家对促癌蛋白BCL6进行了深入研究,最终找到了一种能够诱导癌细胞凋亡的方法。他们发现一种名为转录/表观遗传 CIP(TCIP)的新型分子,能够调控癌细胞内的癌症生长基因表达,从而激活细胞凋亡途径。这种方法可能对大多数的癌症类型产生积极影响。有关这一发现的详细内容已以 Rewiring cancer drivers to activate apoptosis 为题发表于 Nature 期刊。

BCL6 是一种转录因子,可直接抑制编码细胞周期抑制因子的基因和参与细胞凋亡蛋白质的基因。然而,在某些类型的 B 细胞淋巴瘤中,BCL6 的表达被异常激活或过度表达,从而促进癌细胞的增殖、生存和侵袭。
传统观念认为,促癌转录因子是无法通过药物靶向的,那么这项研究是如何将 BCL6 转化为转录激活因子的呢?
在这项研究中,作者采用了一种称为 化学诱导临近(chemical inducers of proximity, CIP)的技术。简单来说,CIP 是一种利用小分子将两个蛋白质靠近,以实现特定生物学效应的方法。
一个经典的 CIP 案例是 PROTAC。正如我们所知,蛋白质降解的自然过程中包括一步叫做泛素化的阶段,这一过程由一个适配蛋白介导,适配蛋白同时与目标蛋白和催化泛素化的酶结合,将它们紧密靠近。这种交互过程已被用于设计被称为 PROTAC 的小分子药物,这些药物模仿适配蛋白的功能,使得特定蛋白质被有针对性地降解,以实现治疗效果。
与 PROTAC 类似,在这项研究中,科研人员合成了一种 双头分子,其中一端与 BCL6 的结合目标结合,另一端与转录激活因子 BRD4 结合。这一创新性的化合物形成了一个三元复合物,与 BRD4 和 BCL6 一同作用,使得 BRD4 能够激活被 BCL6 沉默的基因。科学家们将这一化合物命名为 TCIP(Transcriptional/Epigenetic Chemical Inducer of Proximity)。
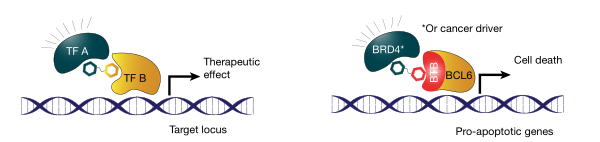
▲TCIP分子的设计
新型抗癌药物——TCIP1
接下来,研究团队选择了TCIP中功能最强的分子——TCIP1,并将其应用于弥漫性大 B 细胞淋巴瘤(DLBCL)的治疗。
在实验中,TCIP1 分子表现出快速、有效地杀伤 DLBCL 细胞的能力,包括对于化疗耐药的 DLBCL 细胞系 KARPAS422 的杀伤作用。在 KARPAS422 细胞系中,TCIP1 分子的半数有效浓度(EC50)为 1.3 nM,仅在 72 小时内即可使 50% 的肿瘤细胞死亡。
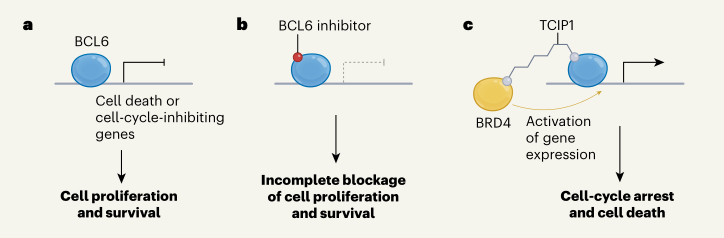
▲TCIP1有效地杀死表达BCL6的癌细胞
这是由于 TCIP1 能够与 BCL6 的 BTB 结构域结合,从而抑制其与核受体共抑制因子(NCOR)、BCL6 共抑制因子(BCOR)以及视黄酸和甲状腺激素受体的沉默介导因子(SMRT)的相互作用。这一作用使得一系列 BCL6 的靶基因能够表达,包括与促进凋亡、细胞周期阻滞以及 DNA 损伤应答有关的基因,如 TP53。通过这种方式,转录调控网络被重新构建,进而激活了细胞凋亡途径,从而有效地抑制了癌细胞的增殖、生存、侵袭和转移。
此外,其他表达 BCL6 的 DLBCL 细胞系同样能够被 TCIP1 分子迅速、有效地消灭。与此对比,仅使用 BRD4 或 BCL6 抑制剂(JQ1或BI3812)的细胞杀伤效果较弱,这表明 TCIP1 分子的选择性杀伤效应不仅仅是将两种抑制剂合并到细胞内的简单叠加。
与此同时,研究团队还合成了负对照化合物 Neg1 和 Neg2,以验证 TCIP1 分子的特异性作用。结果显示,这两种化合物与 BRD4 或 BCL6 的结合能力均受到削弱,因此无法有效地杀伤 DLBCL 细胞。这些实验结果强有力地证明了 TCIP1 分子的选择性杀伤作用,并且 其作用机制需要 BRD4、BCL6 和 TCIP1 三者的三元复合物的共同参与。
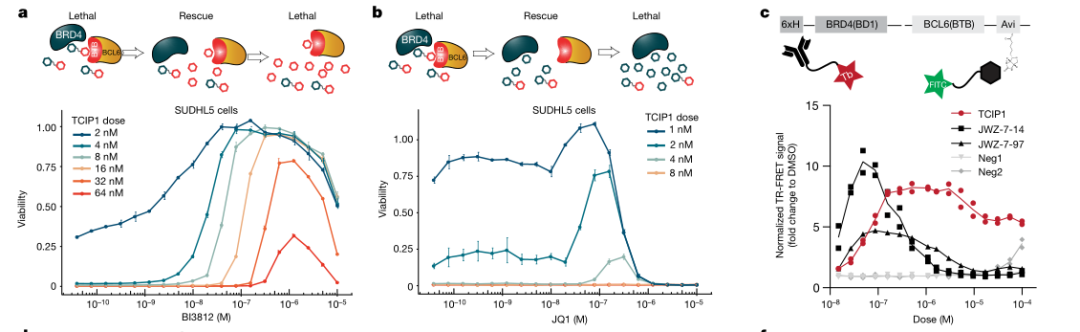
▲TCIP1通过诱导三元复合物形成发挥功能
此外,通过实验观察,科研人员发现 TCIP1 分子诱导 DLBCL 细胞的凋亡不仅限于特定细胞周期阶段,而是在 整个细胞周期中均可发生。他们还鉴定了参与 TCIP1 分子诱导细胞凋亡的直接靶标基因。
通过向 KARPAS422 细胞中添加 10 nM 的 TCIP1 分子,随后分别在不同时间点进行 RNA 测序,科研人员 鉴定了大约 140 个被 TCIP1 分子诱导的基因,其中包括 BCL6 抑制的靶标基因,如 BCL2L11、BIM、PMAIP1、FOXO3 和 BCL6 等。并且,TCIP1 还下调了 MYC(编码转录因子的促肿瘤基因)及其多个转录靶标的表达。这些结果表明,TCIP1 分子能够直接调节多个基因的表达,从而影响细胞的生长和凋亡。
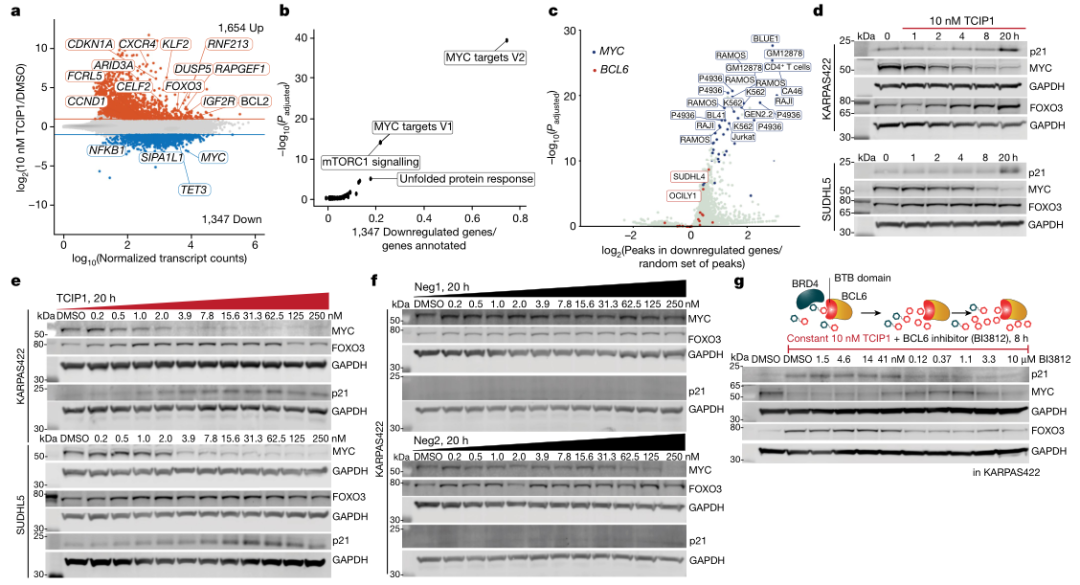
▲TCIP1在激活促凋亡基因的同时抑制MYC及其靶点
总结
综上,该研究介绍了一种新的治疗癌症的策略,即利用TCIP分子来激活细胞死亡途径,从而抑制癌细胞的增殖和生存。研究人员设计了一种双头分子化合物TCIP1,其中一个结合BCL6的分子与另一个结合BRD4的分子相连。这种化合物形成了一个复合物,与基因组中BCL6结合位点上的BRD4和BCL6一起作用,迅速激活转录延伸和相关靶向基因的表达。通过这种方式,TCIP1可以杀死表达BCL6的DLBCL细胞。
作者还讨论了TCIP策略的普适性,认为该策略除了治疗DLBCL外,还可以用于治疗多种表达BCL6的肿瘤。总之,该研究为开发新的癌症治疗策略提供了新思路和方法。
参考资料:
[1] Gourisankar S, Krokhotin A, Ji W, et al. Rewiring cancer drivers to activate apoptosis. Nature. 2023;620(7973):417-425. doi:10.1038/s41586-023-06348-2
[2] Phelan JD, Staudt LM. Double-headed molecule activates cell-death pathways in cancer cells. Nature. 2023;620(7973):285-286. doi:10.1038/d41586-023-02213-4
其他文章

订阅TargetMol新闻
科学新闻、观点和分析的重要汇总,每个工作日都会发送到您的收件箱.

 嗨!有任何问题?点我咨询
嗨!有任何问题?点我咨询

版权所有©2015-2025 TargetMol Chemicals Inc.保留所有权利.
沪ICP备20019793号-4 | 沪公网安备 31010602006700号 | 沪(静)应急管危经许[2024]203441
| 沪(静)应急管危经许[2024]203441
