- 全部删除
 您的购物车当前为空
您的购物车当前为空
PNAS:开发新型CXCR4(CXC趋化因子受体4)靶向药物——HF51116

趋化因子(chemokines)是由细胞分泌的信号传送蛋白,具有诱导附近应答细胞定向趋化的能力,能够与其相应的受体结合,从而引导细胞迁移,可分为CXC、CX3C、C和CC趋化因子四类。趋化因子受体 则属于G 蛋白偶联受体 (GPCR)超家族,同样被划分为四个亚类。
其中,CXCR4(CXC趋化因子受体4)作为趋化因子受体家族的一员,能够介导多种信号通路,诱导一系列生理反应,如细胞增殖、迁移、转录、血管生成以及细胞内钙通量等。同时,CXCR4参与癌细胞转移、造血干细胞动员、炎症反应和自身免疫性疾病的发生。因此,CXCR4也是一个极具吸引力的药物靶点,目前也产生了两款FDA批准的疗法,AMD070 ( mavorixafor ) 以及AMD3100 ( plerixafor ) 。
2025年3月10日,一项发表于 PNAS 的研究聚焦于 CXCR4 的结构与拮抗剂的结合机制,开发出了一种全新结构的小分子拮抗剂 HF51116 ,其具有高亲和力和显著的干细胞动员及抗HIC作用。

HF51116
研究采用片段整合策略开发了小分子 CXCR4 拮抗剂 HF51116。
该分子由三个关键药效团构成:HF50731中的[3-(环己胺)丙基]胺片段、KRH-1636中的L-精氨酸片段,以及AMD3465 中的吡啶-2-基甲胺片段,三者通过一个中央连接基团拼接而成。HF51116对CXCR4具有较高的结合亲和力(IC₅₀ = 12 nM),能够特异性靶向CXCR4,在作为干细胞动员剂方面展现出良好潜力。
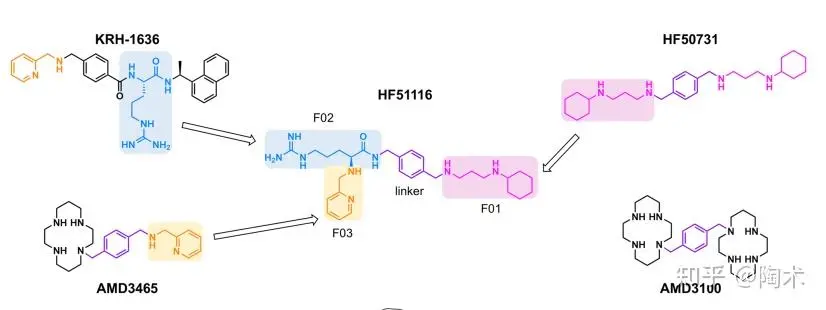
▲HF51116化合物的设计
结构研究表明,HF51116主要结合在CXCR4正构结合口袋的浅表区域,参与结合的区域包括由多个跨膜螺旋(TM2、TM3、TM5、TM6和TM7)构成的结合口袋,形成多点氢键与疏水相互作用,稳定性强
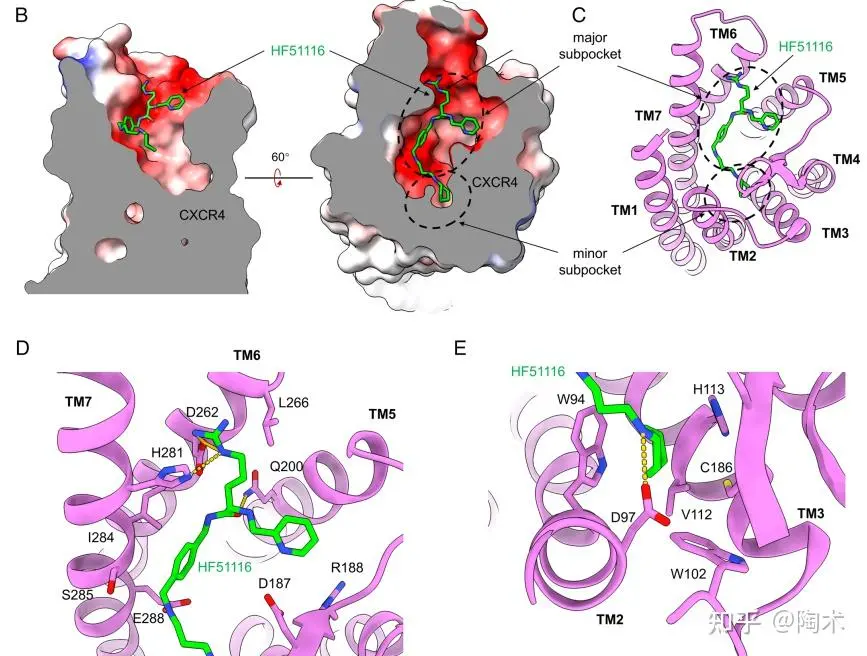
▲HF51116的结合模式
HF51116与AMD070 和 AMD3100 的区别
与FDA已批准的两种 CXCR4 抑制剂 AMD07 0 和 AMD3100 对比,三者结合方式各具特点。
HF51116 结合于 CXCR4 正构口袋的表浅区域,其L-精氨酸和连接臂片段位于由TM5/6/7构成的主子口袋,与关键残基Asp262⁶·⁵⁸、His281⁷·³²、Gln200⁵·³⁹等形成氢键和疏水相互作用;其环己胺片段则位于由TM2/3构成的次子口袋,整体展现出高亲和力(IC₅₀ = 12 nM)。
FDA批准的AMD070深入CXCR4正构口袋,其苯并咪唑环通过疏水堆叠与TM7结合,四氢喹啉环和丁胺链则与Asp97²·⁶³、Glu288⁷·³⁹等形成关键氢键。
AMD3100 是结构对称的双环胺拮抗剂,两个环胺环分别深入受体内部并通过电荷和疏水作用与Asp262⁶·⁵⁸、Glu288⁷·³⁹等关键残基结合,其连接的苯环结构也通过疏水堆叠进一步稳定配体位置。三者结合模式显示出CXCR4拮抗剂在结构设计上可通过不同片段特异性靶向关键残基,以实现高效结合与功能调控。
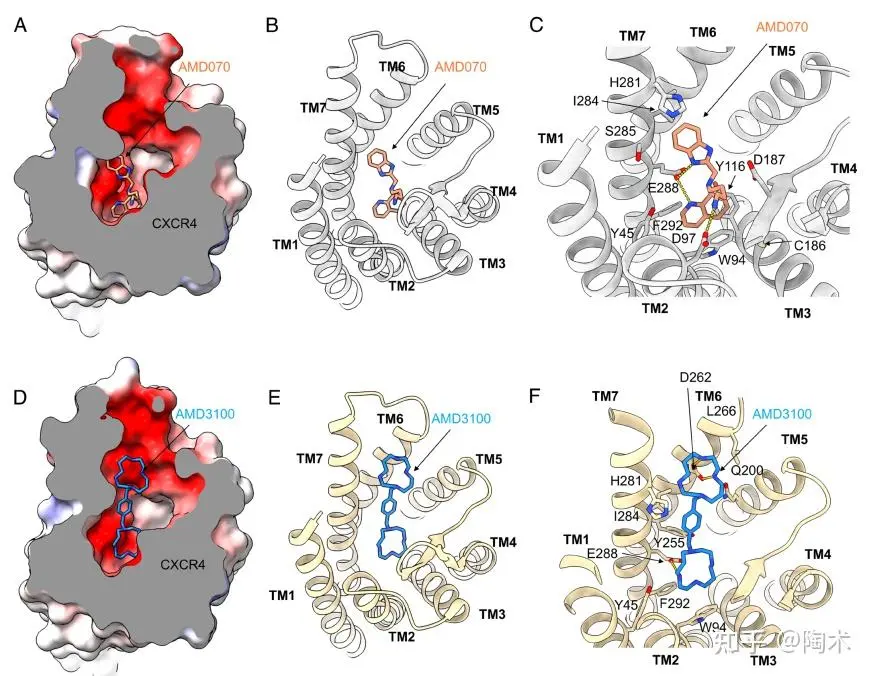
▲AMD070和AMD3100的结合模式
接下来,研究者通过冷冻电镜 结构解析、定点突变和分子动力学模拟,系统揭示了CXCR4受体与三种小分子拮抗剂(HF51116、AMD070 和 AMD3100)之间的结合机制。确定了CXCR4中的关键残基(如Trp94²·⁶⁰、Asp97²·⁶³、Asp262⁶·⁵⁸和Glu288⁷·³⁹)在拮抗剂结合中发挥重要作用,突变这些残基会显著削弱配体结合能力。
分子动力学模拟进一步支持这些残基与配体之间存在稳定的氢键和阳离子–π相互作用,尤其是Trp94²·⁶⁰,其构象变化调节了结合口袋的结构可塑性,使CXCR4能够识别不同类型的拮抗剂,为CXCR4靶向药物的设计提供了关键结构依据。
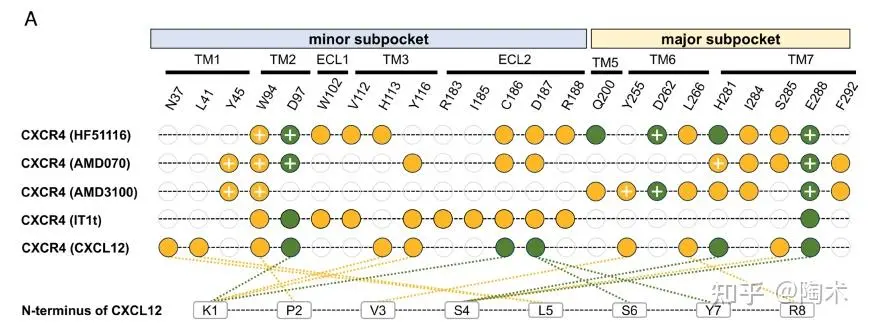
▲CXCR4正构位点不同拮抗剂结合的比较
参与疏水堆积的残基以橙色圆圈表示,参与静电相互作用的残基以深绿色圆圈表示。经过突变验证会影响配体结合的残基,在圆圈内以加号标示。CXCL12 N 端与 CXCR4 之间的相互作用基于 PDB 8U4O 结构分析,并以虚线形式展示。疏水相互作用以橙色虚线表示,静电相互作用以深绿色虚线表示。
小结
综上,该研究通过冷冻电镜技术首次解析了三种CXCR4小分子拮抗剂(HF51116、AMD3100和AMD070)与CXCR4的复合物结构,揭示了其结合位点覆盖CXCR4的主口袋和次口袋,为深入理解CXCR4的拮抗机制提供了重要依据。
研究发现,不同拮抗剂诱导的Trp94²·⁶⁰构象变化可能决定其是否具有部分激动活性,其中HF51116具有独特的结合模式和更强的拮抗作用,表现出纯拮抗剂特征。同时,这些小分子通过阻断CXCL12的关键结合残基发挥作用,未激活CXCR4结构,验证了其拮抗效应。该研究为新一代结构优化的CXCR4小分子药物设计提供了重要的结构基础,有望推动更安全、高效的药物开发。
TargetMol Chemicals Inc.,总部位于美国马萨诸塞州波士顿,作为一家全球性的生物医药领域高科技企业,TargetMol可向全球科学家提供种类丰富的高质量产品和服务,包括抑制剂和激动剂、化合物库、天然产物、重组蛋白、多肽、抗体、试剂盒以及300多种技术服务等,欢迎私信咨询噢!

其他文章


订阅TargetMol新闻
科学新闻、观点和分析的重要汇总,每个工作日都会发送到您的收件箱.