- 全部删除
 您的购物车当前为空
您的购物车当前为空

- 具有直观的搜索结果
- 更便捷高效地比较产品细节
- 快速、简洁的提交订单
- 成为我们TargetMol的一员,阅读和提交您的产品建议和意见
我们很想知道您的意见反馈,所以我们在每个页面上都梳理出一个反馈按钮。

安慰剂是一种不含有活性成分的物质或治疗方法,但它看起来与真正的药物或治疗方法相同。通常用于临床试验中作为对照组的一部分,以便研究人员能够评估一种新药物或治疗方法的真实效果。
安慰剂效应,又被叫做伪药效应、假药效应 、代设剂效应 ,指患者在接受安慰剂治疗时,虽然获得无效的治疗 ,但这种“装模做样”的治疗使得疾病症状得到舒缓的现象。虽然安慰剂效应确切存在,但其神经回路机制仍然未知。
不过,近日一篇发表于Nature 的文章中,研究者运用小鼠模型揭示了安慰剂效应的关键神经回路。

安慰剂效应神经回路?
研究者利用小鼠模型开发了一个为期7天的安慰剂镇痛条件化(PAC)测定法,用于研究安慰剂镇痛效应的基础生物机制。PAC产生了一个基于预期的镇痛效应,具备人类安慰剂镇痛的关键特征,从而能够在小鼠中模拟和研究安慰剂镇痛现象。
测定法包含三个阶段:习惯期(第1-3天)、条件改变期(第4-6天)和条件改变后后镇痛测试期(第7天)。研究者设置了两个视觉效果不同的房间,一个房间温度适宜(30℃),另一个房间温度较高(48℃),能产生痛觉。
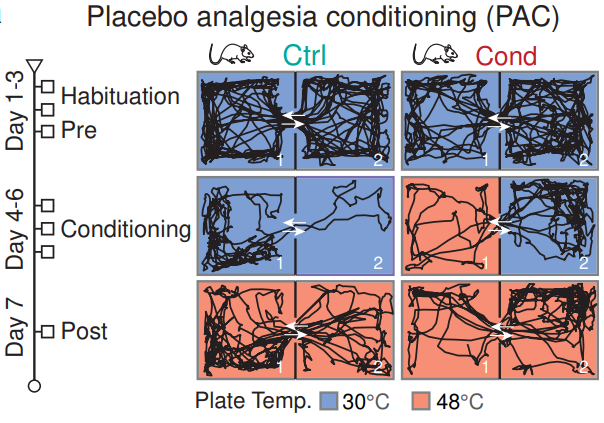
PAC测试及小鼠运动的代表性轨迹
- 在习惯期小鼠可以自由探索两个房间(均为30℃)
- 在条件改变期,房间1的地板温度设置为48°C(产生痛感),房间2保持在30°C(安慰剂),小鼠在离开房间1进入房间2时痛感缓解,于是会停留在凉爽房间更长时间,训练小鼠环境-疼痛反射的反应。
- 在条件改变后镇痛测试期,两个房间的地板温度均设为48°C,以评估痛感缓解预期所诱导的镇痛效应。此时即使两个房间温度相同,小鼠进入房间2后仍会产生痛感缓解的行为。
在开展测定法的同时分析小鼠大脑的神经活动。
人脑成像研究表明,ACC,尤其是前扣带回皮质喙部(rACC),与安慰剂镇痛相关。使用TRAP2 (FosCreERT2) 小鼠模型,研究者注射了依赖Cre表达的腺相关病毒(AAV),允许在PAC期间活跃的rACC神经元的突触前终端标记。通过这种方法,发现标记的第5层rACC神经元有密集的轴突投射到纹状体、丘脑/下丘脑核团和脑桥核(Pn)。
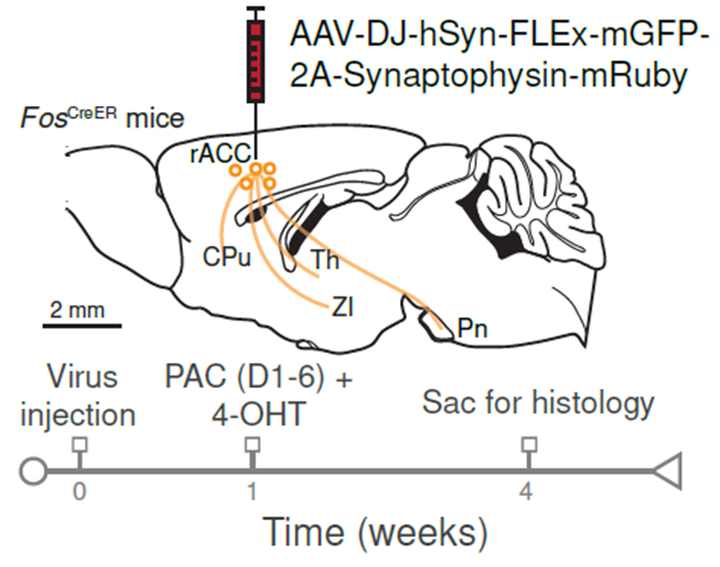
在PAC期间活跃的rACC神经元
在PAC测试期间,rACC→Pn神经元的Ca2+活动逐步增加,通过头戴式显微镜记录、病毒追踪和光遗传学等方法,发现rACC→Pn神经元的活动与痛觉缓解期望密切相关。
通过抑制rACC→Pn通路显著降低了安慰剂镇痛效果,小鼠的疼痛阈值升高;而激活该通路则能在没有安慰剂条件训练的情况下诱导镇痛反应,表现出明显的镇痛效果。
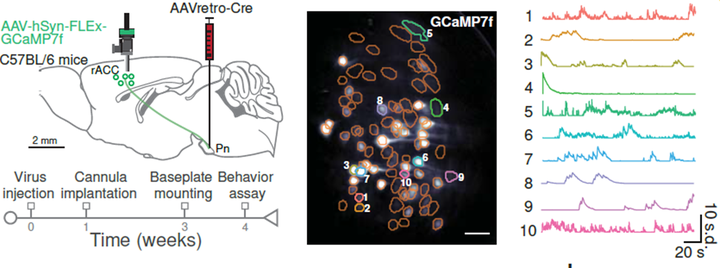
光遗传学操控rACC→Pn通路影响PAC诱导的镇痛和疼痛行为
进一步,研究还发现,安慰剂镇痛依赖于表达δ-阿片受体(Oprd1)的Pn神经元。通过转录组学研究,发现Pn神经元中存在大量的Oprd1表达。通过化学遗传学手段特异性抑制这些Oprd1+ Pn神经元,会导致安慰剂镇痛效果显著减弱,而通过激活这些神经元,可以在没有条件反射的情况下引起镇痛效果。
此外,小脑的神经元(浦肯野细胞)在疼痛缓解期的活动模式与rACC→Pn神经元相似,说明小脑在认知疼痛调节中也发挥着作用。
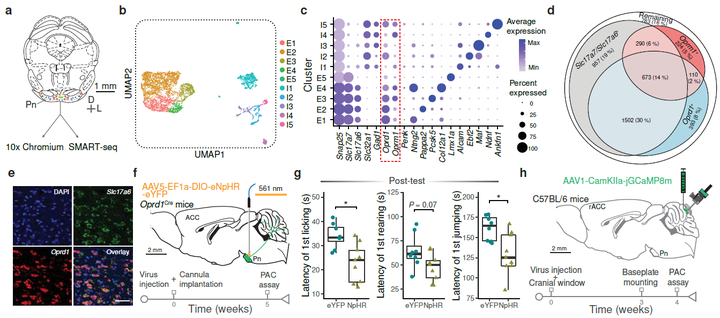
Oprd1+ Pn神经元和小脑Purkinje细胞参与PAC诱导的镇痛
总的来说,这项研究揭示了安慰剂镇痛的神经基础,强调了心理因素如何通过特定的神经回路影响疼痛感知。研究结果为未来的疼痛管理策略提供了新的思路,可能通过靶向这些神经通路来改善疼痛治疗。研究首次明确了前扣带回皮质喙部(rACC)到脑桥核(Pn)的神经通路在安慰剂镇痛中的作用。这一发现为理解安慰剂效应的神经基础提供了新的视角,尤其是Pn在疼痛调节中的潜在角色。
其他文章


订阅TargetMol新闻
科学新闻、观点和分析的重要汇总,每个工作日都会发送到您的收件箱.

 嗨!有任何问题?点我咨询
嗨!有任何问题?点我咨询