- 全部删除
 您的购物车当前为空
您的购物车当前为空

- 具有直观的搜索结果
- 更便捷高效地比较产品细节
- 快速、简洁的提交订单
- 成为我们TargetMol的一员,阅读和提交您的产品建议和意见
我们很想知道您的意见反馈,所以我们在每个页面上都梳理出一个反馈按钮。
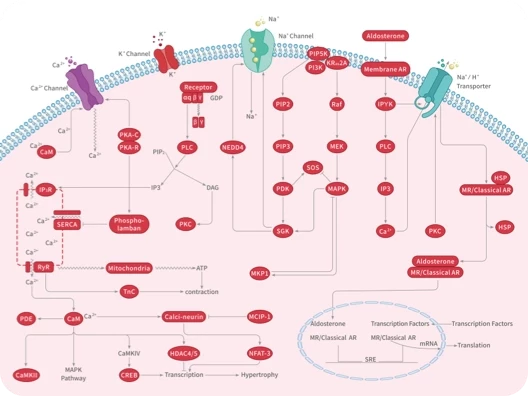
炎症是一个复杂的生物过程,可以消灭病原体并促进损伤组织的修复。但是,免疫系统的失调会导致炎症无法控制并造成损伤。炎症还参与癌症的发生过程,但其分子机制尚未完全揭开,因此,此类药物的开发是一个重大的挑战。
早在2020年,法国国家科学研究中心(CNRS)的Raphaël Rodriguez博士就揭示了一个名为CD44 的膜受体的新作用,该受体标记了免疫反应、炎症和癌症进展。并且有助于铁进入细胞,从而触发一系列反应,导致参与转移过程的基因的激活。
但其作用不止这么简单——
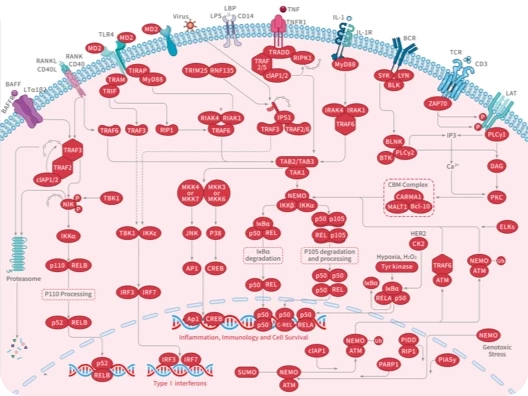
近日,其所在的研究团队又成功的鉴定了一条涉及 CD44 和铜,并导致巨噬细胞中促炎基因表达的信号通路。相关研究结果已以题为A druggable copper-signalling pathway that drives inflammation发表于Nature期刊。

CD44 是一种跨膜黏附糖蛋白,表达于多种细胞中,如胚胎干细胞、分化细胞和癌细胞。也是一种公认的肿瘤干细胞标志物,参与肿瘤的发生、进展和转移。
在这项研究中,研究人员发现,在巨噬细胞激活时,CD44 的表达水平会上调,这会导致细胞对铜的摄取增加。具体来说,CD44 可以与铜结合并将其内化到细胞内部。
研究人员使用了荧光标记的铜离子和荧光显微镜技术来观察铜离子在细胞内的分布情况。结果显示,在 CD44 高表达的巨噬细胞中,荧光信号强度明显增加,并且荧光信号主要分布在细胞质和线粒体中。此外,研究人员还使用了RNA干扰技术来抑制 CD44 的表达,并发现这可以降低铜离子在巨噬细胞中的含量,证明了 CD44 介导了细胞对铜的摄取,并参与了巨噬细胞激活和炎症反应。

▲ CD44介导铜的摄取
进一步,研究人员使用了 Nanoscale secondary ion mass spectrometry (NanoSIMS) 技术来证实线粒体Cu(II)调节细胞可塑性的机制。通过使用一种同位素标记的化合物15N, 13C-LCC-12,并将其添加到巨噬细胞中。然后,他们使用NanoSIMS技术来观察这种化合物在细胞内的分布情况。结果显示,15N, 13C-LCC-12主要分布在线粒体中,并且与荧光标记的细胞色素c信号重叠。这表明LCC-12靶向线粒体,并且可以通过与细胞色素c相互作用来调节线粒体功能和细胞可塑性。
铜信号通路在炎症中的意义是什么?
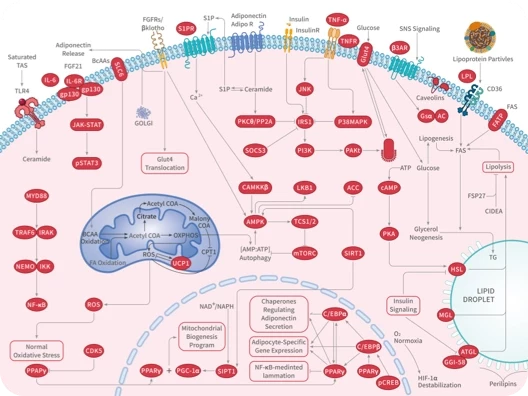
在Cu(II)存在的情况下,NAD(H)会与过氧化氢反应生成NAD+,而在Cu(II)不存在的情况下,则生成复杂的氧化产物。且在巨噬细胞激活过程中,线粒体中超氧化物歧化酶2(SOD2)的蛋白质含量增加,过氧化氢酶(catalase)的含量减少。这导致线粒体中过氧化氢水平升高。因此,Cu(II)可能通过调节 SOD2 和catalase之间的平衡来影响NAD(H)的氧化还原循环。总之,Cu(II)可以通过多种途径影响细胞代谢和功能,并且可能是调节细胞可塑性和适应性的重要因素之一。

▲ Cu(II)调节 NAD(H)氧化还原循环
线粒体中的Cu(II)还可以调节转录。转录是由染色质修饰酶共同调控的,其表达水平和募集在特定的基因组位点形成基因表达。而特定酶如依赖于铁的去甲基化酶和乙酰转移酶则依赖于αKG和乙酰辅酶A等物质。这些物质在线粒体中代谢产生,而线粒体中Cu(II)可能通过影响这些物质的代谢来调节染色质修饰酶的活性,从而影响转录过程。
减轻炎症反应。研究人员在小鼠急性炎症模型中进行了实验,包括内毒素血症、盲肠结扎和穿刺以及SARS-CoV-2感染模型。结果显示,在这些模型中,小腹膜巨噬细胞和肺泡巨噬细胞中的 CD44 表达上调和细胞铜含量增加。而Cu(II)灭活后,CD44 表达下调并且细胞铜含量降低,这可能是因为Cu(II)参与了 CD44 介导的内吞作用,并且内吞过程是调节细胞铜含量的重要途径。因此,Cu(II)灭活可能通过抑制 CD44 介导的内吞作用来减少细胞内铜含量,从而减轻炎症反应。

▲ 铜(II)的药理失活可减轻体内炎症
是否有任何潜在的药物或治疗方法可以针对这个通路治疗炎症性疾病呢?
实验中,通过抑制Cu(II)离子的活性,可以减少炎症反应。这表明铜信号通路可能是治疗炎症性疾病的一个潜在靶点。然而,目前还没有开发出针对这个通路的特定药物或治疗方法。因此,需要进一步的研究来探索这个通路的作用机制,并开发出相应的药物或治疗方法。
总之,该研究发现了一个新的铜信号通路,该通路参与了巨噬细胞的激活和炎症反应。在巨噬细胞激活时,铜(II)离子的含量会增加,并且这种增加是由CD44上调引起的。铜(II)离子可以催化NAD(H)氧化还原循环,从而促进代谢变化和随后的表观遗传学改变,导致炎性状态。
此外,研究人员开发了一种药物metformin二聚体,可以抑制线粒体中铜(II)离子的活性。这种药物可以诱导代谢和表观遗传学转变,对抗巨噬细胞激活并减轻炎症反应。因此,这项研究提供了一个新的治疗策略来治疗与巨噬细胞激活相关的炎性性疾病,并为开发相关药物提供了新思路。
参考文献:
[1] Solier S, Müller S, Cañeque T, et al. A druggable copper-signalling pathway that drives inflammation [published online ahead of print, 2023 Apr 26]. Nature. 2023;1-9. doi:10.1038/s41586-023-06017-4
其他文章


订阅TargetMol新闻
科学新闻、观点和分析的重要汇总,每个工作日都会发送到您的收件箱.

 嗨!有任何问题?点我咨询
嗨!有任何问题?点我咨询