 您的购物车当前为空
您的购物车当前为空
Drug Affinity Responsive Target Stability (DARTS) Assay Kit
一键复制产品信息别名 药物亲和反应靶蛋白稳定性检测试剂盒
药物亲和反应靶蛋白稳定性检测试剂盒(DARTS Assay Kit)基于经典的 DARTS(Drug Affinity Responsive Target Stability)技术,是一种无需化合物修饰即可验证小分子药物与靶蛋白直接结合的实验方法。该技术由Lomenick等人于2009年首次提出,是目前药物靶点发现与作用机制研究中一种灵敏、可靠且易于操作的手段。
本试剂盒提供了DARTS实验所需的关键缓冲液和蛋白酶处理体系,能够高效、灵敏地检测化合物与靶蛋白的结合特性,该方法无需化合物修饰或标记,实验流程简便、结果直观,可与后续的 Western blot、LC-MS/MS或蛋白质组学分析联合使用,为药物研发、靶点发现、机制研究提供高效可靠的实验解决方案。

Drug Affinity Responsive Target Stability (DARTS) Assay Kit
一键复制产品信息药物亲和反应靶蛋白稳定性检测试剂盒(DARTS Assay Kit)基于经典的 DARTS(Drug Affinity Responsive Target Stability)技术,是一种无需化合物修饰即可验证小分子药物与靶蛋白直接结合的实验方法。该技术由Lomenick等人于2009年首次提出,是目前药物靶点发现与作用机制研究中一种灵敏、可靠且易于操作的手段。
本试剂盒提供了DARTS实验所需的关键缓冲液和蛋白酶处理体系,能够高效、灵敏地检测化合物与靶蛋白的结合特性,该方法无需化合物修饰或标记,实验流程简便、结果直观,可与后续的 Western blot、LC-MS/MS或蛋白质组学分析联合使用,为药物研发、靶点发现、机制研究提供高效可靠的实验解决方案。
| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 100 T | ¥ 1,436 | 现货 | |
| 100 T * 5 | ¥ 4,316 | 现货 |
 相关产品推荐
相关产品推荐
 产品原理
产品原理
DARTS的基本原理是:当小分子化合物与靶蛋白结合后,蛋白的三维结构会发生构象变化,使其对蛋白酶(如胰蛋白酶、热蛋白酶K等)的降解敏感性降低,从而表现出更高的“结构稳定性”。
在未结合化合物的样品中,蛋白质在蛋白酶的作用下容易被水解降解;而在加入药物的小分子处理组中,与药物结合的靶蛋白会被保护不被降解。通过比较两组样品中蛋白残留量的差异,即可初步判断药物与蛋白的结合关系。
DARTS方法的核心优势在于:
- 无需对药物进行任何化学修饰或标记,避免改变药物的理化性质或生物活性;
- 适用于天然复杂体系(如细胞裂解液或组织提取液),能在接近生理环境下反映药物-蛋白相互作用;
- 可与Western blot、SDS-PAGE、银染、考染或质谱分析(LC-MS/MS)联合使用,实现从定性验证到靶点鉴定的完整流程。
 产品信息
产品信息
100 T规格的产品组成如下:
| 产品编号 | 产品名称 | 产品包装 |
|---|---|---|
| C0191-1 | Lysis Buffer | 10 mL |
| C0191-2 | Protease | 2 mg |
| C0191-3 | Protease Inhibitor Cocktail (100×) | 0.1 mL |
| C0191-4 | Loading Buffer (5×) | 3 mL |
注:如部分组分使用完毕,C0191-1可用C0047替代,C0191-3可用C0001替代,C0191-4可用C0190替代。
 产品特点
产品特点
- 操作简便:提供完整的缓冲液与蛋白酶体系,无需额外优化条件。
- 高灵敏度:能检测纳摩尔级药物-蛋白结合导致的结构稳定性差异。
- 广泛适用:适用于各种来源的细胞裂解液、组织样品或重组蛋白体系。
- 结果直观:通过Western blot或凝胶染色即可直观比较药物处理组与对照组蛋白降解情况。
- 兼容多种后续分析:可结合LC-MS/MS进行全蛋白组筛选分析,发现潜在的新靶点。
 产品应用
产品应用
小分子药物的靶点筛选与验证、蛋白质与配体相互作用研究、药物作用机制探索。
 应用示意
应用示意

图1. 药物亲和反应靶蛋白稳定性检测试剂盒用于检测乙酰缬草三酯(Acevaltrate, ACE)对于PCBP1蛋白稳定性的效果图。
HCT116细胞(人结肠癌细胞)裂解后,取5 µL浓度为0、0.125、0.25、0.5、1、2 mM的ACE化合物溶液加入至每组体积为100 µL、蛋白量为100 µg总蛋白中,使最终药物浓度为0、6.25、12.5、25、50、100 µM,室温旋转摇床孵育60 min。然后,加入4 µL稀释好的Protease (0.1 µg/µL) (即Protease:Protein=1:250),混匀,37ºC孵育30 min。接着加入1 µL Protease Inhibitor Cocktail (100×) 终止酶解反应,并加入适量Loading buffer (5×),100ºC加热10 min使蛋白变性。最后,通过Western blot检测PCBP1蛋白的酶解情况。结果显示,ACE在100 µM下增强了PCBP1蛋白的稳定性,这表明ACE可能与PCBP1蛋白有结合并增强了其对于蛋白酶的耐受性。实际检测效果会因实验条件、检测仪器等的不同而存在差异,图中效果仅供参考。
参考文献:Yu D, Hu H, Zhang Q, et al. Acevaltrate as a novel ferroptosis inducer with dual targets of PCBP1/2 and GPX4 in colorectal cancer. Signal Transduct Target Ther. 2025 Jul 7;10(1):211.
 操作说明
操作说明
1. 细胞收集与裂解:
将HCT116细胞吹散后接种于100 mm培养皿中,培养至细胞密度为85%-90%后,吸除培养基,用PBS洗涤细胞两次后弃掉,再次加入1 mL PBS,用细胞刮刀迅速将细胞从培养皿上刮下(或用胰酶消化收集),转移至1.5 mL离心管中,200 g离心5 min,将PBS弃去。加入适量新鲜配置的含蛋白酶抑制剂以及磷酸酶抑制剂的Lysis Buffer轻轻吹散,置于冰上裂解15 min,12000 rpm、4℃离心15 min。收集离心后的上清液,测定蛋白浓度。推荐使用BCA法或Bradford法进行蛋白定量。根据蛋白浓度测定结果调整蛋白浓度,确保蛋白浓度在1-5 mg/mL。
注:蛋白样品制备完成后,建议立即进行后续实验步骤。若需保存,可将样品分装成适当体积后置于-80°C 保存。长期储存时应尽量避免反复冻融,以防止蛋白降解或活性损失。
2. 酶解比例探索(推荐优先确认酶解比例):
a)配置Protease储备液:用超纯水配置为10 µg/µL,分装后置于-20℃保存,避免反复冻融,建议在6个月内使用完毕。
b)配置不同比例的酶工作液:取一管母液置于冰上融化,融化后取4 µL加入196 µL超纯水(稀释成50倍,即0.2 µg/µL)。现配现用,具体需根据实验结果调整稀释比例。
下表是以各组样本总蛋白量为100 µg为例,2倍稀释共配置8管酶工作液,最终配置好后A-G每管100 µL,H管200 µL。8管蛋白样品中每管加入4 µL酶工作液,另外准备1管不加酶的样品加入4 µL超纯水作为空白对照。
| 酶工作液编号 | 酶与蛋白质量比例 | 所需酶总量(µg) | 所需酶浓度(µg/µL) | 酶用量(µL) | 超纯水用量(µL) |
|---|---|---|---|---|---|
| A | 1:125 | 0.8 | 0.2 | 4 µL酶母液 | 196 |
| B | 1:250 | 0.4 | 0.1 | 100 µL A | 100 |
| C | 1:500 | 0.2 | 0.05 | 100 µL B | 100 |
| D | 1:1000 | 0.1 | 0.025 | 100 µL C | 100 |
| E | 1:2000 | 0.05 | 0.0125 | 100 µL D | 100 |
| F | 1:4000 | 0.025 | 0.00625 | 100 µL E | 100 |
| G | 1:8000 | 0.0125 | 0.003125 | 100 µL F | 100 |
| H | 1:16000 | 0.00625 | 0.0015625 | 100 µL G | 100 |
c)上述9管样品每管混匀后涡旋离心,在37℃恒温下孵育30 min。
d)孵育结束立即加入Protease Inhibitor Cocktail (100×)终止酶解反应。
e)每管加入定量Loading Buffer (5×)(例如100 µL的反应体系加入25 µL的Loading Buffer (5×)),100℃加热10 min终止反应,于-20℃暂时保存样品。
f)进行Western检测PCBP1蛋白的酶解情况。检测结果如下图。
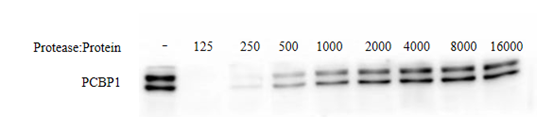
图2. 药物亲和反应靶蛋白稳定性检测试剂盒用于不同Protease与总蛋白比例的检测效果图。
每组100 µL 100 µg的HCT116细胞总蛋白,加入4 µL稀释好的Protease工作液。混匀,37℃孵育30 min进行蛋白消化。孵育结束后加入1 µL Protease Inhibitor Cocktail (100×) 终止反应,并加入Loading buffer (5×),混匀后100℃加热10 min。随后通过Western blot检测PCBP1蛋白的酶解情况。结果显示Protease和蛋白比例约为1:250时,蛋白条带变化明显,便于后续实验观察小分子药物是否能影响蛋白的稳定性。实际检测效果会因实验条件、检测仪器等的不同而存在差异,图中效果仅供参考。
3. 药物处理:
a)根据参考文献或实验设计,设置合适的药物浓度梯度,并由药物母液逐级稀释,制备所需浓度的药物工作液。例如,可设置0、0.125、0.25、0.5、1、2 mM等不同浓度。每次实验应包含两类对照组:阴性对照组(Negative Control):未加入Protease;空白对照组(Blank Control):既不加Protease,也不加药物,仅加入药物对应的溶剂(如纯水或DMSO)。推荐每管加入100 µL、1 mg/mL的蛋白样品(即总蛋白量约100 µg),蛋白浓度与体积应与步骤2b保持一致。
b)在各实验管中分别加入5 µL不同浓度的药物工作液。空白对照组中加入等体积的药物溶剂(如纯水或DMSO)。轻轻混匀后,于室温摇床孵育60 min,或在4°C条件下避光孵育过夜。孵育的温度与时间可根据药物性质及参考资料调整。
4. 酶解处理:
a)配置Protease储备液:用超纯水配置为10 µg/µL,分装后置于-20℃保存,避免反复冻融,建议在6个月内使用完毕。
b)制备Protease工作液:根据步骤2中确定的Protease与样品中总蛋白量的比例,从Protease储备液稀释制备所需浓度的Protease工作液。稀释操作应在冰上进行,以保持酶的稳定性和活性。
c)加酶反应:在各实验组中加入4 µL预先稀释好的Protease工作液;在阴性对照组中加入等体积的超纯水代替Protease。
注:酶解前的蛋白样品应始终保持在冰上或4°C条件下。
d)酶解孵育:轻轻混匀后短暂离心,使液体集中于管底。将样品置于37°C恒温孵育30 min以进行蛋白酶消化。
e)终止反应:孵育结束后,立即加入Protease Inhibitor Cocktail (100×) 以终止酶解反应。例如在100 µL反应体系中加入1 µL Protease Inhibitor Cocktail (100×)。
5. 样品处理和保存:
通常可通过多种检测手段评估药物对靶蛋白稳定性的影响:
若研究目的蛋白已知,可利用Western blot分析其在药物处理前后对蛋白酶消化的耐受性变化;
若需探究药物对未知靶标蛋白的作用,则可采用LC-MS/MS鉴定药物结合后蛋白稳定性的变化;
对于具有明确酶活性的靶蛋白,还可结合酶活性检测方法进行高通量筛选;
此外,在靶标蛋白明确的情况下,也可根据实验需求选择 ELISA 等其他检测方式。
以下以Western blot与LC-MS/MS检测为示例:
a)根据样品体积加入相应比例的Loading buffer (5×),例如在100 µL的反应体系中加入25 µL Loading buffer (5×)。
b)在100°C加热10 min,使蛋白充分变性。
c)加热处理后的样品可直接用于后续分析。若验证药物的已知靶点,可直接进行Western blot检测;若探索未知靶点或新型作用蛋白,可采用LC-MS/MS等蛋白组学分析。如样品暂不使用,应立即置于-80°C保存,以防止蛋白降解或结构变化。
 保存条件
保存条件
-20℃,1年。
 注意事项
注意事项
- 蛋白样品制备后应尽快进行实验,以防蛋白降解或活性丧失。若需保存,请分装后置于-80°C,避免反复冻融。
- 除孵育及酶解步骤外,其他操作(如样品处理、酶稀释等)应尽量在冰上或4°C条件下进行,以维持蛋白稳定性和酶活性。
- Protease浓度对实验结果影响较大,过量蛋白酶可能导致非特异性降解,推荐优先进行预实验确认酶解比例。
- 药物浓度、孵育时间和温度需根据具体药物特性或参考文献进行优化。高浓度药物或长时间孵育可能导致非特异性蛋白变化。
- Protease 储备液和工作液应避免长时间放置,建议现配现用,使用后立即封盖并置于 -20°C 保存。
- 加入Protease Inhibitor Cocktail (100×) 终止反应后,应立即混匀,防止酶解继续进行。
- 本品仅适用于专业科研用途,严禁用于临床诊断、治疗、食品或药品领域,且不得存放于住宅等非专业场所。
- 为保障操作安全与人员健康,操作时请务必穿戴实验服并佩戴一次性手套。

版权所有©2015-2026 TargetMol Chemicals Inc.保留所有权利.
沪ICP备20019793号-4 | 沪公网安备 31010602006700号 | 沪(静)应急管危经许[2024]203441
| 沪(静)应急管危经许[2024]203441



 很棒
很棒